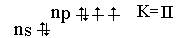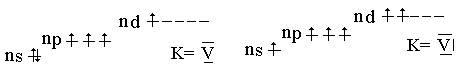|
|
Кислород и его соединенияЛЕКЦИЯ 1 Химия р-элементов. Общие закономерности. Р- элементы -это элементы главных подгрупп III - VIII групп. У р-элеме-нтов валентными являются электроны и орбитали внешнего энергетического уровня. Число внешних электронов равно номеру группы. В периодах с ростом атом-ного номера элемента эффективные атомные радиусы уменьшаются, энергия ионизации, сродства к электрону, электроотрицательность увеличива-ются. В группах с с ростом атомного номера элемента эффективные атомные радиусы увеличиваются, энергия ионизации, сродства к электрону, электро-отрицательность уменьшаются. Однако, не всегда свойства элементов изме-няются монотонно, в характере изменения свойств по периоду проявляется внутренняя периодичность, а в группе - вторичная периодичность. Так, энергия ионизации бериллия больше, чем у бора, азота больше, чем кислорода, что можно объяснить с помощью представлений об экранировании ядра. Эффект экранирования ядра обусловлен электронами внутренних слоев, которые заслоняя ядро, ослабляют притяжение к нему внешнего электрона. Явление вторичной периодичности можно объяснить исходя из представлений о проникновению электронов к ядру, так как в соответствии с квантово-волновой теорией любой электрон некоторое время может находится в области близкой к ядру. Эффект проникновения увеличивает связь внешних электронов с ядром, поэтому при переходе от Si к Ge, от Pb Sn энергия ионизации не уменьшается, а увеличивается. У р-элементов валентными являются электроны внешнего энергетического уровня. При участии в образовании связи всех валентных электронов элемент проявляет высшую степень окисления, которая равна номеру группы. Энергетически более стабильны соединения, в которых элементы нечетных групп проявляют нечетные степени окисления, а четных групп – четные степени окисления. При переходе от III к VIII группе высшая степень окисления элемента становится все менее устойчивой, что объясняется увеличением энергетического различия между s- и p- орбиталями внешнего слоя атома, а, следовательно, и уменьшением возможности участия в образовании химической связи ns2 –электронов. При этом энергетическое различие между ns и nр- уровнями для элементов 4-го периода выше, чем для 3-го и 5-го. Особенно велико различие между энергиями 6 s и 6р, поэтому для р-элементов 6 периода высшая степень окисления неустойчива. Элементы главной подгруппы VII группы В данную подгруппу входят : фтор, хлор, бром, йод и астат.
В ряду : F CI Br I At Эффективный атомный радиус увеличивается
Энергия сродства к электрону, энергия ионозации, электроотрицательность уменьшаются
Элементы VII группы в невозбужденном состоянии имеют электронную конфигурацию ns2nр5 :
Э0…ns2nр5; При возбуждении (кроме фтора ) элементы подгруппы проявляют ковалентность, равную III, V и VII :
Фтор проявляет степени окисления -1 и 0 , для остальных элементов подгруппы возможны степени окисления : -I , 0, +1, +3,+4, +5 и +7. Распространение в природе. Наиболее распространенные соединения фтора – флюорит CaF2 , криолит Na3[AlF6], фторапатит 3Ca(PO4)2 2CaF2. Хлор содержится в океанской воде, в виде каменной соли NaCl, сильвинита NaCl·KCl и карналлита KMgCl3·6H2O. Бром и иод самостоятельных месторождений не образуют, их добывают из буровых и подземных вод, кроме этого иод добывают из золы морских водорослей. Распространенность галогенов в природе уменьшается от фтора к иоду. Получение. В лаборатории хлор, бром и йод получают по реакциям : MnO2 + 4HCI = MnCI2 + CI2 + 2H2O ; Cl2 + 2КBr = Br2 + 2КCl Cl2 + 2К J = J2 + 2КCl. Фтор в промышленности получают исключительно электролизом расплава KF·2HF ( в водном растворе это невозможно , так как фтор реагирует с водой с выделением кислорода). 2F2 + 2H2O = 2HF+O2 . Хлор получают электролизом растворов или расплавов солей: 2NaCl +2H2O → 2NaOH +2H2 + Cl2 2NaCl Бром и йод получают окисляя в водных растворах ионы Br- и J, хлором, напри-мер: 2NaJ + Cl2 = J20↓ + 2NaCl.
Химические свойства Хлор, как и все элементы 3-го периода, отличается от своего аналога фтора, элемента 2-го периода, наличием d- подуровня. Этим определяется его характер и поведение при химических реакциях. Использование d-орбиталей приводит к образованию кратных дативных связей . Именно поэтому энергия диссоциации молекулы хлора примерно в полтора раза больше , чем у фтора. У полных электронных аналогов хлора, брома и йода, также наблюдаются подобные явления, хотя и в меньшей степени, это объясняется влиянием больших радиусов атомов брома и иода. Фтор. Фтор химически очень активен, он сильнейший окислитель. Высокая химии-ческая активность фтора объясняется тем, что его молекула имеет очень низкую энергию диссоциации, тогда как химическая связь в большинстве соединений фтора отличается большой прочностью. Он легко взаимодействует со всеми ме-таллами и неметаллами, включая даже некоторые инертные газы. Фторид водорода неограниченно растворяется в воде: 2HF + H2O = H3O+ + HF2- Раствор HF (плавиковая кислота) кислота средней силы . Характерной осо-бенностью плавиковой кислоты является ее способность реагировать с SiO2 , поэ-тому HF хранят в полиэтиленовой таре. : SiO2 + 4HF = SiF4↑+2H2О. HF получают действуя H2SO4 на плавиковый шпат : CaF2 + H2 SO4 = CaSO4↓ + 2HF. Хлор В соединениях хлор проявляет следующие степени окисления: -1, 0, +1, +3,+5,+7. Степени окисления хлора +2 , +4 и +6 реализуются только в безразличных, легко диспропорционирующих, неустойчивых оксидах ClO, ClO2 и СlO3. Степени окисления –1 соответствует хлористый водород HСl, являющийся газообразным соединением. Это наиболее важное соединение хлора. Получить его можно при непосредственном взаимодействии хлора с водородом: H2+Cl2 = 2HCl. В чистом виде HCl – газ с резким запахом, очень легко растворяется в воде – при О0 С в 1л воды растворяется более 500 л HCl. Раствор HCl имеет кислую реакцию и называется хлороводородной кислотой( соляная кислота) . Это сильная кислота реагирует, со всеми металлами, стоящими в ряду напряжения до водорода. Соли хлороводородной кислоты называются хлоридами. Положительным степеням окисления хлора соответствуют оксиды и гидроксиды:
Все оксиды и кислородные кислоты хлора неустойчивы. Оксиды обычно разлагаются со взрывом. Устойчивость кислородных кислот и их сила возрастают от HClO к HClO4 , а окислительные свойства кислот и их солей уменьшаются.
HClO HClO2 HClO3 HClO4
Оксид хлора (I) получают взаимодействием хлора с оксидом ртути (II):
Он представляет собой ядовитый желто-коричневый газ с характерным запахом. При нагревании взрывается с образованием хлора и кислорода. При растворении в воде Cl2O образует слабую (слабее угольной ) хлорноватистую кислоту HClO, соли которой называются гипохлоритами. Эта кислота образуется и при взаимодействии хлора с водой в темноте. Cl2+H2O↔HClO+HCl
Cl0 + H20-1e= HClO+H+__________
HСlO − неустойчивое соединение и на свету разлагается по схеме HClO → HCl +O0.
Cl2 + 2КOH = КCl + КClO + H2O
1 Cl0+2OH- -e- = ClO -+ H2O Cl2 +2OH- = ClO - + Cl- +H2O
При пропускании хлора в горячий раствор щелочи протекает реакция: 3Сl2+6KOH = KClO3 + 5KCl + 3H2О
5 Cl0 + 1e = Cl-
3Cl2 +6OH- = ClO - + 5Cl- +3H2O
При взаимодействии хлора с гашеной известью образуется хлорная известь: Cl2 + Ca(OH)2= CaOCl2 + H2О Полученный продукт можно рассматривать как соль двух кислот – HСl и HClO:
Ca
OСl
При пропускании хлора в горячие растворы щелочей образуются соли хлорноватой кислоты – хлораты : Cl2 + 6KOH= KClO3 + 5KCl + 3H2O Для получения хлорноватой кислоты раствор хлората бария обрабатывают H2SO4 : Ba(ClO3)2 + H2SO4 = 2HClO3 + BaSO4↓. Таким способом удается получить растворы 40 – 50%-й концентрации HСlO3– сильная кислота, сильный окислитель, но уступающий по окислительным свойствам HClO, ее соли, хлораты, в обычных условиях устойчивы. Наиболее устойчив из всех кислотных соединений хлора оксид Cl2O7. Его получают дегидратацией хлорной кислоты: 6HClO4 + P2O5 = 3Cl2O7 + 2H 3PO4. Cl2O7 при быстром нагревании или при ударе взрывается, с водой образует хлорную кислоту, а со щелочами перхлораты : Cl2O7 + H2О = 2HClO4 Cl2O7 + 2КОН = 2KClO4 + H2O. HClO4 относится к очень сильным кислотам. Как сама кислота , так и ее соли в растворах практически не обладают окислительными свойствами . В безводных средах эти соединения могут проявлять сильные окислительные свойства , хотя они и слабее , чем у других кислородных кислот хлора.
Соединения брома и иода В отличие от фтора и хлора бром при обычных условиях является подвижной темно-красной жидкостью с tкип =590С , а иод – твердое вещество темно-серого цвета с металлическими блеском. Йод способен возгоняться (переходить в газообразное состояние минуя точку плавления). Бром и йод проявляют степени окисления –1, 0, +1,+3,+5, +7 них наибо-лее устойчивы –1 и +5. В степени окисления –1 галогены образуют летучие во-дородные соединения, растворы которых являются кислотами. Свойства этих кислот изменяются следующим образом: HF HCl HBr HJ
Эти изменения свойств объясняются уменьшением электроотрицательности и увелечением радиусов атомов от фтора к иоду. Из кислородных соединений наиболее устойчивы оксиды брома: Br2О, BrO2 и Br2O3. Существует только две малоустойчивых кислоты: HBrO (бромноватис-тая) и HBrO3 (бромноватая). Другие кислородные кислоты брома в свободном состоянии не получены. Соли этих кислот аналогичны солям хлора в той же степени окисления . Они являются сильными окислителями . Иод образует только один устойчивый оксид J2O5 и гидроксиды HJO, HJO3, H5JO6 (HJO4 •2H2O). Наиболее устойчивыми гидроксидами брома и иода являются HBrO3 и HJO3. Это подтверждается тем, что при действии на бром и йод сильных окислителей получаются ионы BrO3- и JO3- Br2 +5Cl2 +6H2О=2HBrO3 +10HCl
Br2 + 6 H2O + 5Cl2 = BrO3¯ + 10Cl¯ +12H+
J2 + 5HClO+H2O= 2HJO3 +5HCl.
I2 + 6 H2O + CIO¯+5 H2O ¯= IO3¯+ 12H++ 5CI¯ +10OH¯
В ряду HClO3 – HBrO3 – HJO3 кислотные свойства ослабевают, а устойчивость соединений увеличивается, а следовательно, уменьшаются окислительные свойства анионов . В связи с неустойчивостью степени окисления +1, по сравнению с хлором, реакции диспропорционирования брома и иода в растворах щелочей идут до степени окисления +5 : 3J2+ 6КОН = 5КJ + КJO3 + 3H2О. Каждый из галогенов может образовывать соединения с другими более электроотрицательными галогенами. Эти соединения называют интергалидами. Большинство интергалогенидов являются фторидами : Cl2 + 3F2 = 2ClF3 Наиболее устойчивыми среди этих соединений являются ClF3, BrF5, и JF7. Интергалогениды обладают кислотным характером. Они быстро и полностью гидролизуются водой, например : JCl3 + 2H2О = 3HCl+ HJO2
HJ HJO3
ЛЕКЦИЯ 2 Элементы VI группы главной подгруппы
К р-элементам VI группы периодичесrой системы элементов Д.И. Менделеева относятся кислород, сера, селен, теллур и полоний. Кислород и сера являются типическими элементами; селен, теллур и полоний образуют семейство селена. В ряду : O S Se Te Po Эффективный атомный радиус увеличивается
Энергия сродства к электрону, энергия ионозации, электроотрицательность уменьшаются
Металлические свойства и восстановительная способность увеличиваются
р –элементы VI группы в невозбужденном состоянии имеют ns2nр4 валент- -ные электроны, распределенные по квантовым ячейкам: Э0…ns2nр4
При возбуждении (кроме кислорода) элементы подгруппы проявляют кова-лентность равную IV и VI:
Кроме кислорода, который может проявлять степени окисления -2, -1 (формаль-но) 0, и +2 , для остальных элементов подгруппы возможны степени окисления: -2; -1 (формально), 0, +2, +4,+6. Для серы наиболее характерны низшая и высшая степени окисления. Кислород и его соединения Кислород при обычных условиях – газ без цвета и запаха. Это наиболее распространенный элемент земной коры . Вследствие количественного пре-обладания и большой окислительной активности кислород предопределяет форму существования на Земле химических элементов. Известно свыше 1400 минералов, содержащих кислород. В природе существует круговорот кисло-рода. Естественное пополнение его происходит за счет фотосинтеза растениями и фитоплактоном океана и разложения воды в верхних слоях атмосферы. Кислород существует в виде двух аллотропных модификаций : О2 и О3 (озон). Наиболее устойчива двухатомная молекула. Молекула кислорода слабо поляризуется, поэтому межмолекулярные связи между ними очень слабые, этим же объясняются низкие температуры плавления (-218 0С ) и кипения ( -1830С) кислорода.Он плохо растворяется в воде ( 5 объемов в 100 объемах воды при 0 0С. Жидкий и твердый кислород притягивается магнитом, так как его молекулы паромагнитны ( имеют два неспаренных электрона). Твердый кислород синего цвета, а жидкий - голубого. В промышленности кислород получают фракционной перегонкой жидко-го воздуха и электролизом воды. Аллотропную модификацию кислорода – озон можно рассматривать как соединение О( IV ) – ОО2 . В природе озон образуется по цепному механизму под действием солнечного света. Озоновый слой в верхних слоях атмосферы защищает Землю от ультрафиолетового излучения, но будучи токсичным ве-ществом ( ПДК 0,1 мг /м3 ) , озон в нижних слоях атмосферы опасен для здо-ровья людей. Озон соединение эндотермическое, но тем не менее в отсутствии катализатора или без ультрафиолетового излучения газообразный озон разлагается очень медленно даже при 250 0С. Жидкий озон и его концентрированные смеси взрывчаты. В промышленности озон получают электрическим разрядом в сухом воздухе или электролизом воды. Соединения кислорода. Кислород при нагревании и в присутствии катализатора проявляет высокую химическую активность. С большинством простых веществ он взаимодействует непосредственно, образуя оксиды ; лишь по отношению к фтору проявляет восстановительные свойства. Оксиды можно разделить на солеобразующие и несолеобразующие ( безразличные ) . Безразличные оксиды – это оксиды неметаллов в низших положитель-ных степенях окисления, например: CO, NO, N2O . Они не взаимодействуют с водой, не образуют гидроксиды. Солеобразующие оксиды делятся на основные, кислотные и амфотерные. Основные оксиды образуют металлы в степенях окисления +1 и +2( иск-лючения BeO, ZnO , SnO, PbO - амфотерные) . Например: K2O, CaO, FeO. Амфотерные оксиды- это оксиды металлов в степенях окисления +3 и +4. Например: Al2O3, Cr2O3. Кислотные оксиды образуют неметаллы во всех степенях окисления и металлы в степенях окисления + 5, + 6,+ 7. Например, SO2, SO3, P2O5, Mn2O7. Различие в свойствах оксидов разного типа проявляются при их взаимодействии с водой : K2O + 2Н2O = 2KOН + Н2 P2O5 + Н2O = K3PO4 Амфотерные оксиды с водой не взаимодействуют. Важнейшим из оксидов является оксид водорода - вода. Общее ее количество составляет 1,4 1018 т, она покрывает примерно четыре пятых площади земной поверхности. Она играет исключительную роль в природе, в жизнедеятельности растений, животных, человека. Вода составляет 50- 99% массы любого живого существа. При продолжительности жизни 75 лет человек выпивает 25 т воды. Исключительная роль воды обусловлена ее свойствами. Вода термодинамически устойчивое соединение. Температура плавления воды 0 0С, кипения 1000С, плотность при 200С – 0,998 г /см3 . Свойства воды существенно отличаются от свойств водородных соединений остальных элементов шестой группы. При обычных условиях вода находится в жидком состоянии, в то время как указанные соединения –газы. Температура кристаллизации и испарения воды значительно выше температур кристаллизации и испарения водородных соединений остальных элементов шестой группы. Максимальную плотность вода имеет при температуре 4 0С, что также необычно. В отличие от других соединений плотность воды при кристаллизации не растет, а уменьшается. Необычные свойства воды обусловлены, в основном, тремя причинами : полярным характером молекул, наличием неподеленной пары электронов у атома кислорода и образование водородной связи. Вследствие полярности молекул вода хорошо растворяет полярные жидкости и соединения с ионным типом связи. Водородные связи обуславливают ассоциацию молекул воды в жидком состоянии и некоторые аномальные свойства воды, а также особую структуру льда. В кристаллах льда молекула воды образует четыре водородные связи с соседними молекулами воды, что обуславливает тетраэдрической кристал-лической структуры льда. Расположение молекул в таком кристалле отличает-ся от плотной упаковки молекул, в решетке много свободных мест, поэтому лед имеет относительно невысокую плотность. При плавлении происходит частич-ное разрушение структуры льда и сближение молекул, поэтому плотность во-ды возрастает. В тоже время повышение температуры усиливает движение мо-лекул, которое снижает плотность вещества. При температурах выше 4 0С пос-ледний эффект начинает превалировать и плотность воды понижается. В жидкой воде молекулы ассоциированы, при этом устанавливается равновесие между молекулами воды, связанными в ассоциаты, и свободными молеклами воды. Наличие ассоциатов повышает температуры кристаллиза-ции и испарения воды , диэлектрическую проницаемость. При увеличении температуры ассоциаты разрушаются, растет доля свободных молекул, поэ-тому водяной пар при высоких давлениях состоит из свободных молекул воды. Однако при повышении давления молекулы воды сближаются, образу-ются водородные связи, при этом пар по своему строению приближается к жидкому состоянию. Это вызывает увеличение растворимости в паре соединений с ионным типом связи. Соединения перокидного типа.При химических превращениях моле-кула О2 может терять или присоединять электроны с образованием молеку-лярных ионов типа О2 2- , О2 - , О2 + . Присоединение одного электрона к моле-куле кислорода вызывает образование надпероксид иона О2 - , образование над-пероксидов характерно для наиболее активных щелочных металлов (K, Rb, Cs) : K + О2 = KO2 Присоединяя два электрона молекула кислорода превращается в перок-сид ион О2 2- , образование пероксидов характерно для таких металлов как Na и Ba, например : Ва + О2 = ВаО2 Наибольшее практическое применение имеет пероксид водорода. Моле-кула перекиси водорода сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, что приводит к их ассоциации , поэтому в обычных условиях перекись водорода сиропообразная жидкость бледно голу-бого цвета с довольно высокой температурой кипения (150 0С ). Пероксид водо-рода хороший ионизирующий растворитель, который благодаря водородным связям смешивается с водой в любых отношениях. В лаборатории обычно пользуются 3% и 30 % растворами Н2О2 , последний называют пергидролем. В водных растворах перекись – слабая кислота : Н2О2 …Н2О2 ↔ ОН3 + + НО2 – В химических реакциях пероксид-радикал может, не изменяясь перехо-дить в другие соединения, например : ВаО2 + H2SO4 = Ва SO4 + H2 О В окислительно-восстановительных реакциях пероксиды могут играть роль как окислителя, так и восстановителя, например : KI + Н2О2 + H2SO4 = I2 + K2SO4+ Н2О 1 2I- -2e = I2 1 Н2О2 + 2e + 2H+ = 2Н2О2 2I- + Н2О2 + 2H+ = I2 + 2Н2О2 2KMnO4 +5Н2О2 + 3H2SO4 = 2MnSO4 + 5О2 + K2SO4+ 8Н2О 5 Н2О2 -2e = О2 + 2H+ 2 MnO4 - + 5e + 8H+ = Mn2+ + 4Н2О 5 Н2О2 + 2MnO4- + 16H+ = О2 + 10H+ + 2Mn2+ + 8Н2О Окислительные свойства пероксидов выражены сильнее, чем восстано-вительные. Для пероксида водорода характерны реакции диспропорционирования :
Н2О2 = О2 + Н2О Этот распад ускоряется в присутствии катализаторов, примесей, освеще-нии, нагревании. Пероксид водорода хранят в темной посуде и на холоде, для стабилизации добавляюм ингибиторы. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

 Неметаллические свойства и окислительная способность уменьшаются
Неметаллические свойства и окислительная способность уменьшаются

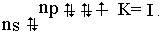
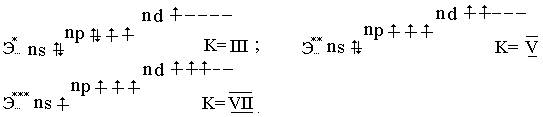
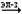 2Na + Cl2.
2Na + Cl2. усиление кислотных свойств
усиление кислотных свойств усиление окислительной активности
усиление окислительной активности Hg-Cl
Hg-Cl 2HgO + 2Cl2 = Cl2О + О Hg-Cl .
2HgO + 2Cl2 = Cl2О + О Hg-Cl . Cl0 + 1e = Cl-
Cl0 + 1e = Cl- Cl2+H2O=HClO + H++ Cl-
Cl2+H2O=HClO + H++ Cl-
 Выделением атомарного кислорода объясняется дезинфирующее и отбеливающее действие хлорной воды . Сам хлор этими свойствами практически не обладает. Гипохлориты − более устойчивы, чем сама кислота. Образование иона ClO- облегчается в щелочной среде (реакция протекает на холоду ) :
Выделением атомарного кислорода объясняется дезинфирующее и отбеливающее действие хлорной воды . Сам хлор этими свойствами практически не обладает. Гипохлориты − более устойчивы, чем сама кислота. Образование иона ClO- облегчается в щелочной среде (реакция протекает на холоду ) : 1 Cl0 + 1e = Cl-
1 Cl0 + 1e = Cl- 1 Cl0+6OH- -5e-= ClO3-+3H2O
1 Cl0+6OH- -5e-= ClO3-+3H2O
 Cl
Cl
 Анализируя свойства кислородных соединений хлора можно сделать вывод, что в ряду ClО- - ClO2 – ClO3 – ClO4 устойчивость ионов увеличивается и, следователь-но, уменьшаются окислительные свойства. Гипохлориты являются сильными окислителями в любой среде. Хлораты в растворах окисляют только в сильно-кислой среде .
Анализируя свойства кислородных соединений хлора можно сделать вывод, что в ряду ClО- - ClO2 – ClO3 – ClO4 устойчивость ионов увеличивается и, следователь-но, уменьшаются окислительные свойства. Гипохлориты являются сильными окислителями в любой среде. Хлораты в растворах окисляют только в сильно-кислой среде . сила кислот увеличивается
сила кислот увеличивается восстановительные свойства увеличиваются
восстановительные свойства увеличиваются устойчивость соединений уменьшается
устойчивость соединений уменьшается
 1 Br20 + 6 H2O -5e = 2BrO3¯ + 12H+
1 Br20 + 6 H2O -5e = 2BrO3¯ + 12H+ 5 Cl20 + 2e = 2Cl¯
5 Cl20 + 2e = 2Cl¯


 Неметаллические свойства и окислительная способность уменьшаются
Неметаллические свойства и окислительная способность уменьшаются