
|
|
Коагуляция золей смесями электролитов.Антагонизм,синергизм и аддитивное действие электролитов.Чередование зон коагуляции.Привыкание золей.Если применяется смесь электролитов то механизм коагуляции осложняется.Происходит смещение адсорбционного равновесия,которое сопровождается перераспределением ионов двойного слоя и изменением порога коагуляции.Наблюдаемые при этом явления можно свести к 3 следующим:антагонизм,синергизм,аддитивности.1.Аддитивность-действие смеси=сумме коагулирующих эффектов состовляющих её электролитов.2)антагонизм-явление ослабления действия коагулирующего эектролита при добавлении другого.3)синергизм-действие одного электролита усиливается при добавлении другого. .
Если электролит добавлять к золю небольшими порциями, то в итоге коагуляция наступает при более высокой концентрации электролита, чем при внесении сразу большого его количества.такое явление называют привыканием золя. Причиной привыкания золей м.б. образование пептизатора или адсорбция ионов, заряженных одноименно с частицей, что приводит к повышению первоначального заряда частиц. Стабилизация коллоидных систем. Ионная и молекулярная стабилизация. Защита золей от коагуляции с помощью высокомолекулярных веществ. Сенсибилизация СТАБИЛИЗАЦИЯ - процесс создания защитных ионных или молекулярных слоев на межфазных границах, которые придают системе агрегативную устойчивость. Стабилизация коллоидных систем осуществляется образованием заряженного адсорбционного слоя в гранулах. Одноименно заряженные гранулы отталкиваются друг от друга, что препятствует их слипанию. Этому способствуют также дипольные молекулы воды, ориентированные у диффузных слоев мицелл. У гидрофильных коллоидов также около заряженных групп (-СОО-, -NН , - ОН- и др.) удерживается много молекул воды, препятствуя их слипанию. Коллоидная защита — предохранение коллоидных растворов от коагуляции и, следовательно, повышение их устойчивости добавлением небольших количеств высокомолекулярных веществ (белков, крахмала, агар-агара и др.), так называемых защитных веществ.Наиболее сильным защитным действием обладают белки:желатин и т.д, аболее слабым-крахмал,сапонины и т.дЗащитное действие по отношению к различным коллоидам не одинаково.Защитное действие зависит:1)природы стабилизатора2)состава среды. СЕНСИБИЛИЗАЦИЯ - агрегация частиц при введении полимеров и коллоидных ПАВ в количестве, недостаточном для защиты дисперсий. Это явление имеет место при низких содержаниях макромолекул в среде и объясняется стягивающим действием, которое производят молекулы полимера, одновременно адсорбирующиеся на двух частицах («мостик»). Используется при очистке сточных вод от дисперсных частиц. Коллоидные ПАВ:мыла,детергенты,таниды,некоторые красители. Мицеллообразование в растворах коллоидных ПАВ. Критическая концентрация миццелообразования и её определение. Солюбилизация и её значение в фармации. Коллоидные ПАВ в фармации В зависимости от рн,температуры и вприсутствии системы электролитов образ.изистинных,коллоидныерастворы.ПАВ классифицируют по разным признакам:1)по растворимости. существуют водорастворимые и жирорастворимые.2.по способности молекул диссоциировать на ионы Ионогенные ПАВ подразделяются на 3 группы: Анионоактивные–щелочные соли высших жирных карбоновых кислот(мыла) -Растворимые соли высокомолекулярных сульфокислот СnH2n+1 SO3Me -сульфоэфиры высших спиртов и их соли-мыла с двух и трёхвалентными Катионоактивные: соли четвертичных аммониевых оснований,солиаминов,солиамилпиридиновых соединений. Амфотерные: Алкиламинокислоты,белки.2Аминофенолы 3ФОсфатиды(фосфалипиды)растительного и животного происхождения(лецитин) Неионогенные ПАВ:Продукты конденсации оксида этилена с высокомолекулярными кислотами и спиртами.-Эфиры глицерина(эмульгаторТ-2,моностеарат глицерина 3.по способности к миццелообразованию.ПАВ обладающие достаточно длиной углеводородной цепью,называютмицеллобразующими или коллоидными ПАВ.Мыла,детергенты,таннины,некоторыекрасители,алкалоилы-являясь истинно растворимыми соединениями,способны также к образованию мицеллярных коллоидных растворов.При большом разбавлении ПАВ находятся в растворе в виде отдельных молекул или ионов и их растворы являются истинными.С увеличением ПАВ их молекулы или ионы ассоциируют друг с другом и образуют мицеллы ПАВ.Мицеллообразование в растворах ПАВ начинается с соединений содержащих более 4-5 атомов углерода в цепи.Процессмицеллообразования протекает самопроизвольно и обратимо.Истинный раствор⇌ коллоидный раствор ⇌гель Мицеллярные растворы ПАВ-это системы термодинамическиустойчивые,равновесные и обратимые. Критическая концентрация мицеллообразования(ККМ)-концентраци ПАВ при которой в его растворе возникает большое число мицелл,находящихся в теродинамическом равновесии с молекулами,ирезко изменяется ряд свойств раствора.Факторы влияющие на ККМ. 1)влияние длины углеводородного радикала2)влияние электролитов3)влияние полярных органических веществ большая молярная масса-понижает ККМ.малая-повышает4)влияние температуры. ионогенные-ККМ растёт с ростом температуру. неионогенные-ККМ снижается с ростом температуры. Солюбилизация-растворение в мицеллярных растворах ПАВ веществ не растворимых в чистых растворителях при этом ПАВ солюбилизатор.вещество которое растворяют-солюбилизат.Обратнаясолюбилизация-растворение воды в маслах в присутствии растворимых коллоидных ПАВ.Применениесолюбилизаторов в фармации позволяет готовить лек. Формы с нерастворимыми в воде лекарственными веществами.(цитостатиков,витамины А и Е).Применение ПАВ в фармации.преимущества 1)отсутствие токсичности2)стойкость против воздействия микроорганизмов и в процессе хранения3)отсутствие запаха,вкуса и окраски4)доступность5)эффективность.Приме.мыла,дезинфицирующиесредства,солюбилизаторывитаминов,антибиотиков и т.д 85.Получение и общие свойства суспензий.Устойчивость суспензий и её нарушение.Флокуляция.Седиментационный анализ суспензий.Пасты.Применение суспензий в фармации.Суспензия-микрогетерогенные системы свободнодисперсные с твёрдой дисперсной фазой и жидкой дисперсной средой.Размер частиц от 10-7 до 10 -5 м.Суспензии можно получить:1.конденсперционным2.диспергационный3.конденсационный 2-ой метод состит в том что вещество дисп.фазы дробят в присутствии малого количества дисперсионнойысреды 0,4-0,6 мл/г. 3 метод при смешивании сырья и водного раствора происходит замена растворителя и обр-сясуспензия.Свойствасуспензий:В следствии большого размера частиц слабо проявляющиеся молек-кинетические свойства незначительное Броуновское движение.-Светорассеивание не проявляется размер частиц больше волны падающего света.-Являются кинетически неустойчивыми системами.частицы фазы оседают под силой тяжести.-обладают большим запасом поверхностной энергии-на поверхности суспензии,есть двойной электрический слой.-Устойчивость можно повысить при добавленииПАВ а также работы электролибов.Факторы устойчивости суспензии:НаличиеДх-структурно-механический(при адсорбции на поверхности частиц ПАВ или ВМВ) –Сольватационный(при адсорбции молекул растворителя)Фокуляция-это один из видов коагуляции, при которой более мелкие частицы, находящиеся во взвешенном состоянии в воде, под влиянием специально добавляемых веществ (флокулянтов), образуют интенсивно оседающие скопления в виде хлопьев.Седиментационный анализ-зависимость скорость оседания частиц от радиуса выражает закон Стокса r — радиус Стокса частицы (м),g— ускорение свободного падения (м/с²),ρ— плотность частиц (кг/м³), ρ0— плотность жидкости (кг/м³),µ— вязкость среды (Па с). Проведение седиментационного анализа Пасты-это высококонцентрированные суспензии полученные при повышении концентрации дисперсной фазы до предельно возможной величины в агрегативно устойчивых суспензиях.Применение суспензий в фармации:исп. В виде лек.форм,обусловленно более быстрым проявление фармокологическогодействия,чем в таблетках и порошках.Пример: линименты,новоциллин,камфары и т.д В фарм. Практике применяют желатозу,крахмал,яичный порошок.
Эмульсии: методы получения,свойства.Типыэмульсий.Механизм действия эмульгаторов.Обращение фаз эмульсий.Структурно-механический фактор устойчивости концентрированных эмульсий.(П.А.Ребиндер).Коалесценция.Применение эмульсий в фармации. Эмульсии-агрегатно не устойчивые дисперсные системы,т.к обладают большим запасом поверхностной энергии и термодинамически не устойчивы.По концентрации:1)разбавленные-содержание не более 0,1% 2)концентрированные-более 0,1-74% 3)высококонцентрированные более 74%. Дисперсные системы ж/ж.Грубодисперсные.Условия образования: полная или частичная нерастворимость одной жидкости в другой.Методы получения: 1)Диспергационный: вещество дисперсной фазы смешивают с эмульгатором,а затем смесь соединяют с дисперсной средой.2)конденсационный- через среду пропускают сразу в виде паров,пары конденсации образуют эмульсии.Эмульсии стерильны) Самопроизвольное диспергирование-система содерж. Масло в воде и ПАВ самопроизвольно может переходить в эмульсию.Типы эмульсий: 1 типаН/Н2О-гидрофильные больше 10 2типа в/м-гидрофобные 3-10. Способы определения типа эмульсии. –по электропроводности:эмульсия типа м/в хорошо проводит эл. Ток,а типа в/м-плохо.-избирательное окрашивание: Эмульсия м/в+водорастворимый краситель(метил.синий). Эмульсия м/в+жирорастворимый краситель(судан 3).Обращение фаз эмульсии:переход эмульсии из прямого типа в эмульсию обратного типа и наоборот.Для определения возможности образования эмульсии определённого типа существуют различные теории:геометрические и энергетические.Геометрическая-фактором является форма молекул ПАВ.Энергетические основаны на закономерностях,выражаемых правилом Банкрофта и системой ГЛБ Правило Банкрофта: Гидрофильные эмульгаторы способствуют образованию эмульсии 1 типа,а гидрофобные 2 типа.Тип образования эмульсии,зависит от типа добавл.эмульгатора.от соотношения фаз. Факторы устойчивости эмульсии: 1 рода,ДЭС(ионогенные эмульгаторы),структурно-механические,сальватационный(неионногенные эмульсии).2 рода структурно-механические,энтропийный. Энтропийныйфактор:углевод.радикалы ПАВ и ВМВ адсорб. На поверхностных частиц.фазы способные совершать Броуноввскоедвижение.Эмульгаторы-растворимые ПАВ и ВМС или нерастворимые порошкообразные вещества,добавление которых к эмульсиям делает их устойчивыми. Эмульгаторы 1 типа:порошки-СаСО3,Са SO4,глина и тд. ВМВ-желатин,казеин,крахмал, лецитин. ПАВ- мыл щелочных металлов,желчные кислоты.2 типа.Порошки- тальк,сажа и т.д ВМВ-смолы, каучук и т.д ПАВ-мыла многовалентных металлов,холестерин.Прим.фарм.Эмульсии играют большую роль в жизнедеятельности человека.Жиры вводятся в организм в виде прямых эмульсий или эмульгируются в организме. Получили широкое распространение в качестве фармацевтических препаратов для внутривенного, наружного или инъекционнногоприменения.Отдельную группу составляют косметические эмульсии. Аэрозоли и их свойства.Получениеаэрозолей.Молекулярно-кинетические свойства аэрозолей.Электрическиесвойства.Агрегативная устойчивость и факторы её определяющие.Разрушение аэрозолей и применение аэрозолей в фармации. Аэрозоли- свободно-дисперсные системы с газообразной дисперсионной средой и дисперсной фазой,состоящей из твёрдых или жидких частиц.Различают дисперсионные и конденсационные аэрозоли. Дисперсионные аэрозоли образуются при измельчении (диспергировании) твердых и жидких веществ. Конденсационные аэрозоли образуются при конденсации насыщенных паров, а также в результате газовых реакций.К аэрозолям относятся пыли, туманы и дымы.Пылями называют дисперсионные аэрозоли с твердыми частицами, независимо от дисперсности. Пылью обычно также называют совокупность осевших частиц (гель или аэрогель).Под туманами понимают газообразную среду с жидкими частицами как конденсационными, так и дисперсионными, независимо от их дисперсности.Дымами называют конденсационные аэрозоли с твердой дисперсной фазой или включающие частицы и твердые, и жидкие.Аэрозоли являются агрег.не устойчивые системы.Агрегации частиц происходит приувеличении размера частиц,система теряет кинетичускуюустойчивость.Факторыустойчивости:Наличиеэл.заряда на частицах.-Адсорбция молекул газа на частицах.Свойствааэрозолей:Интенсивное броуновское движение.-Высокое светорассеивание..-Выраженная агрегативнаянеустойчивость.Специфическиесвойства:термофорез-движение частиц аэрозоля в направлении области более низких температур.Фотофорез-перемещение частиц аэрозоля при одностороннем освещении.Термопреципитация-осаждение частиц аэрозоля на холодных поверхностях за счёт потери частицами кинетической энергии.Коагуляцияаэрозолей.Скорость коагуляции зависит от: численной концентрации,конвекционныхпотоков,механическогоперемешивания,ультрозвуковыхколебаний.Прим.фарм.Стерильные аэрозоли в спец.упаковках типа баллонов применяют для стерил. Операционного поля,ран и ожогов:ингаляционные аэрозоли-для лечения дых.путей.
88.Порошки и их свойства.Слёживаемость,гранулирование и распыляемостьпорошков.Применение в фарм.Порошки- свободно-дисперсные системы с газообразной дисперсионной средой и твёрдой дисперсной фазой.КЛАССИФИКАЦИЯ ПОРОШКОВ1. По форме частиц: • равноосные (имеют примерно одинаковые размеры по трем осям); • волокнистые (длина частиц гораздо больше ширины и толщины); • плоские (длина и ширина значительно больше толщины). 2. По межчастичному взаимодействию: • связно дисперсные (частицы сцеплены между собой, т. е. система обладает некоторой структурой); • свободнодисперсные (сопротивление сдвигу обусловлено только трением между частицами). 3. Классификация по размерам частиц дисперсной фазы: • песок (2≤10-5 ≤ d ≤ 2∙10-3) м;• пыль (2∙10-6 ≤ d ≤ 2∙10-5) м; • пудра (d < 2∙10-6) м.Порошки, так же как любую другую дисперсную систему, можно получить двумя группами методов: • со стороны грубодисперсных систем — диспергационными методами; • со стороны истинных растворов — конденсационными методами.Свойствахар-ся:насыпной плотностью,слипаемостью,сыпучестью,гидроскопичностью,смачиваемостью,горючестью.Гранулирование(грануляция) — формирование твердых частиц (гранул) определенных размеров и формы с заданными свойствами. Размер гранул зависит от вида материала, способа его дальнейшей переработки и применения и составляет обычно (в мм):для минеральных удобрений — 1-4; для термопластов — 2-5;для реактопластов — 0,2-1,0;для каучуков и резиновых смесей — 15-25;для лекарственных препаратов (таблетки) — 3—25.Слеживание — процесс, обусловленный длительным нахождением сыпучих материалов в неподвижном состоянии. В результате слеживания сыпучие материалы теряют способность течь и могут превратиться в монолит. Особый вред слеживание оказывает при хранении муки, сахара, крахмала, дрожжей и других пищевых масс.Распыляемость зависит от сил сцепления между частицами, т.е. от природы порошка, размера частиц и влажности. Распыляемость следует учитывать при практическом применении порошков. Для снижения распыляемости порошки гранулируют, т.е. путем механического воздействия формируют крупные агрегаты сферической формы, рассыпающиеся в порошок при сравнительно легком надавливании. Гранулированные порошки имеют меньший объем, не пылят, обладают повышенной текучестью, что удобно для их перевозки и переработки.Прим.фарм.Широкое применение порошков в медицинской практике связано с положительными сторонами их как лекарственной формы. Порошки удобны для приема, их можно точно дозировать. В форме порошков возможно сочетание различных по своему составу и свойствам лекарственных веществ. Порошки удобны для транспортировки и хранения, приготовление их сравнительно несложно. Однако порошки не лишены и некоторых недостатков: действие их обычно наступает несколько медленнее по сравнению с жидкими лекарствами. При применении в форме порошков некоторых лекарственных веществ возможно и раздражающее действие на слизистую. По сравнению с неизмельченными твердыми веществами порошки обладают большей гигроскопичностью, а те из них, которые содержат кристаллизационную воду, могут, наоборот, выветриваться.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Чередование зон коагуляции(следствие перезарядкизоля) Наблюдается при добавлении к отрицательному золюэлектролитов с многозарядными катионами–коагулянтами: Fe3+; Аl3+; Th4+.
Чередование зон коагуляции(следствие перезарядкизоля) Наблюдается при добавлении к отрицательному золюэлектролитов с многозарядными катионами–коагулянтами: Fe3+; Аl3+; Th4+.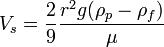 Vs — установившаяся скорость частицы (м/с)
Vs — установившаяся скорость частицы (м/с)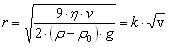
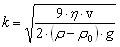 к-коэффициент пропорциональности
к-коэффициент пропорциональности