|
|
Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгоффа.Предмет, задачи и методы физической химии. Основные этапы развития. Роль отечественных и зарубежных ученых в ее развитии Ломоносов, Бекетов основоположники физической химии. Значение физической химии в медицине и фармации. Физическая химия – наука , в котором изучаются химические свойства веществ на основе физических свойств составляющих их атомов и молекул. Осн. Задача – выявление детального механизма явлений, изучение и объяснение основных закономерностей, определяющих направление химических процессов, скорость их протекания, влияние на них среды, примесей, излучения и других внешних факторов. Установление связи между строением в-ва и его реакционной способностью. Название физическая химия введено Ломоносовым, им же дано ее определение, сформулированы предмет и задачи, установлен один из основных законов – закон сохранения массы при химических превращениях. Бекетов внес огромную роль в развитие физ. Химии как самостоятельной науки и учебной дисциплины. На первом этапе развития физич. Химия изучала макроскопические системы и процессы. Сегодня ее структура значительно расширилась. Теперь она включает в себя учение о строение атома, ионов и молекул, коллоидную химию, отдельные разделы фотохимии и электрохимии и др. Роль в медицине и фармации: У становление химической структуры ЛВ. Учение о фазовых равновесиях позволяет выбирать условия синтеза и очистки ЛП, решать вопросы совместимости при изготовлении ЛФ, предсказывать возможности взаимодействия м.д отдельными компонентами. Учение о растворах является основой для приготовления жидких ЛС. Электрохимические методы анализа применяются в контроле производства ЛВ и в анализе готовых ЛС.
Предмет и задачи термодинамики. Системы: изолированные, открытые, закрытые. Состояние систем. Функция состояния. Внутренняя энергия системы. Работа и теплота. Первое начало термодинамики, его математическое выражение. Термодинамика изучает энергетику физ. и химич. процессов переход энергии м.д телами в виде тепла и работы. Цель – исследование возможности направления и предела протекания химических реакций при данных условиях. Открытые системы обмениваются с окружающей средой и веществом и энергией. Все живые организмы. Закрытые обмениваются с окруж.средой энергией но не обмениваются массой. Колба закрытая пробкой. Изолированные не обмениваются ни энергией ни веществом. Термос. Состояние системы – это совокупность физических и химических св-в которыми характеризуется данная система. T, P, V, C – это параметры системы. Могут быть измерены непосредственно. Функция состояния – это термодинамический параметр, изменение которого не зависит от пути протекания процесса а зависит от начального и конечного состояния системы. ΔS, ΔU – изменение внутренней энергии, ΔF, ΔG. Первое начало термодинамики связывает м.д собой U, A, Q. δQ=dU+δA Q=ΔU+A U- внутренняя энергия системы, это движение атомов, электронов, ядер за исключением кинетической и потенциальной энергии системы как целого. [A] [Q] [U] - [Дж] Q – теплота это энергия передаваемая за счет хаотического столкновения молекул двух соприкасающихся тел или систем. А – работа процесс направленный, упорядоченный. «Теплота проведенная к системе тратится на изменение внутренней энергии и работу совершаемую системой»
Первое начало термодинамики. Понятие внутренней энергии и работы. Энтальпия – как функция состояния системы. Изохорные и изобарные тепловые эффекты и соотношение между ними. V – const изохорный процесс. А= Р * ΔV= P*(V2 - V1) – работа расширения V – const ; ΔV =0 А=0 Qv = ΔV т.о теплота является функцией состояния
Р – const изобарный Q = (U2 – U1) + P(V2 – V1) U+PV = H H – (энтальпия) тепловой эффект реакции. Теплосодержание системы. Qp = H2 – H1 = ΔH Теплота изобарного процесса – функция состояния
Закон Гесса, его значение. Термохимические уравнения. Стандартные теплоты образования и сгорания. Вычисление тепловых эффектов по стандартным теплотам образования и сгорания. Калориметрическое определение теплоты растворения соли. З-н Гесса математическое выражение Qv = ΔV Qp = ΔH «Теплота изохорного и изобарного процесса являются функцией состояния» 1840г Qp – Qv = Δn * R* T Qv меньше Qp Закон является основой для термохимии, которая занимается расчетом теплового эффекта. Следствие 1: тепловой эффект реакции равен разности между суммой теплот обра- зования конечных продуктов и суммой теплот образования исходных ве- ществ с учетом их стехиометрических коэффициентов: ΔH°298 р-ии = Σn * ΔH°298 прод - Σn * ΔH°298исх в-в
Теплота образования – это энтальпия реакции образования 1 моль вещества из составляющих его простых веществ. При этом принимается, что простые вещества реагируют в виде той модификации и в том агрегат- ном состоянии, которые отвечают наиболее устойчивому их состоянию при данной температуре и давлении 1 атм. Для термохимических расчетов ре- акций, в которых участвуют простые вещества, теплота образования этих простых веществ условно принята равной нулю. Следствие 2: ΔH°298 р-ии = Σn * ΔH°298 исх - Σn * ΔH°298прод Теплота сгорания – это энтальпия реакции окисления кислородом одного моль данного соединения до образования высших оксидов. В каче- стве продуктов сгорания элементов С, Н, N, S, Cl (Br) принимают СО2(г.). Термохимические измерения проводят в специальных приборах – калориметрах. В ходе эксперимента определяют вызванное данным процессом изменение температуры. При работе с калориметром наблюдают частые потери тепла в окружающую среду, что искажает разницу температур начала и конца процесса. Для определения истинного изменения температуры используют графический метод.
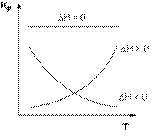
Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгоффа. Теплоемкость – это количество теплоты необходимое для нагревания одного моль вещества на 1 градус. Сv = (∂H/dT)v изохорн Cp = (∂H/dT)p Уравнения Кирхгоффа частное производное теплового эффекта Cp – Сv = R если ΔCp>0 то с увеличением Т тепловой эффект р-ии возрастает. (∂H/dT)p >0 Если ΔCp = 0 (∂H/dT)p = 0 Если ΔCp < 0 (∂H/dT)p < 0

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|