
|
|
Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции. Правило Вант-Гоффа. Ускоренные методы определения срока годности ЛВ.Скорость хим.реакции возрастает с повышением температуры. Оценить возрастание скорости реакции с температурой можно воспользовавшись правилом Вант-Гоффа. Согласно правилу повышение температуры на 10 градусов увеличивает константу скорости реакции в 2-4 раза:
Это правило не выполняется при высоких температурах, когда константа скорости с температурой почти не изменяется. Правило Вант-Гоффа позволяет быстро определить срок годности ЛВ. Повышение температуры увеличивает скорость разложения препарата. Это сокращает время установления срока годности лекарства. Метод заключается в том, что ЛВ выдерживают пи повешенной температуре Т определенное время tТ , находят количество разложившегося препарата m и пересчитывают на стандартную температуру хранения 298К. Считая процесс разложения ЛВ реакцией первого порядка, выражают скорость при выбранной температуре Т и Т =298К:
Откуда:
Считая массу разложившегося препарата одинаковой для стандартных и реальных условий хранения, скорости разложения можно выразить равенствами:
Откуда
Принимая T=298+10n, где n = 1,2,3…,
Получают окончательное выражение для срока хранения ЛВ при стандартных условиях 298К:
Теория активных соударений. Энергия активации. Уравнение Аррениуса. Связь между скоростью реакции и энергии активации. Теория активных соударений была сформулирована С. Аррениусом в 1889 году. В основе этой теории лежит представление о том, что для протекания химической реакции необходимо соударение между молекулами исходных веществ, а число соударений определяется интенсивностью теплового движения молекул, т.е. зависит от температуры. Но не каждое соударение молекул приводит к химическому превращению: к нему приводит лишь активное соударение. Активные соударения – это соударения, которые происходят, например, между молекулами А и В с большим запасом энергии. Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называется энергетическим барьером реакции. Энергия активации - это избыток энергии, которую можно сообщить или передать одному моль вещества. Энергия активации ощутимо влияет на значение константы скорости реакции и ее зависимости от температуры: чем больше Еа, тем меньше константа скорости и тем значительнее влияет на нее изменение температуры. Константа скорости реакции связана с энергией активации сложной зависимостью, описанной уравнением Аррениуса:
k=Aе–Ea/RT, где А – предэкспоненциальный множитель; Еа – энергия активации, R – универсальная газовая постоянная, равная 8,31 дж/моль; Т – абсолютная температура; е-основание натуральных логарифмов. Однако наблюдаемые константы скорости реакции, как правило, гораздо меньше, вычисленных по уравнению Аррениуса. Поэтому уравнение для константы скорости реакции видоизменяют следующим образом:
Множитель
Особенности гетерогенных реакций. Скорость гетерогенных реакций и факторы её определяющие. Кинетическая и диффузионная области гетерогенных процессов. Примеры гетерогенных реакций, представляющих интерес для фармации. ГЕТЕРОГЕННЫЕ РЕАКЦИИ, хим. реакции с участием веществв, находящихся в разл. фазах и составляющих в совокупности гетерогенную систему. Типичные гетерогенные реакции: термич. разложение солей с образованием газообразных и твердых продуктов (напр., СаСО3 -> СаО + СО2), восстановление оксидов металлов водородом или углеродом (напр., РЬО + С -> Рb + СО), растворение металлов в кислотах (напр., Zn + + H2SO4 -> ZnSO4 + Н2), взаимод. твердых реагентов (А12О3 + NiO -> NiAl2O4). В особый класс выделяют гетерогенно-каталитические реакции, протекающие на поверхности катализатора; при этом реагенты и продукты могут и не находиться в разных фазах. Направление, при реакции N2 + + ЗН2 -> 2NH3, протекающей на поверхности железного катализатора, реагенты и продукт реакции находятся в газовой фазе и образуют гомогенную систему. Особенности гетерогенных реакций обусловлены участием в них конденсированных фаз. Это затрудняет перемешивание и транспорт реагентов и продуктов; возможна активация молекул реагентов на поверхности раздела фаз. Кинетика любой гетерогенной реакции определяется как скоростью самого хим. превращения, так и процессами переноса (диффузией), необходимыми для восполнения расхода реагирующих веществ и удаления из реакционной зоны продуктов реакции. В отсутствие диффузионных затруднений скорость гетерогенной реакции пропорциональна размерам реакционной зоны; так называется удельная скорость реакции, рассчитанная на единицу поверхности (или объема) реакц. зоны, не изменяется во времени; для простых (одностадийных) реакций она м.б. определена на основе действующих масс закона. Этот закон не выполняется, если диффузия веществ протекает медленнее, чем хим. р-ция; в этом случае наблюдаемая скорость гетерогенной реакции описывается уравнениями диффузионной кинетики. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы. Факторы, влияющие на скорость химической реакции: - природа реагирующих веществ, - концентрация реагентов, - температура, - наличие катализатора. Vгетерог= Δп(S Δt), где Vгетерог — скорость реакции в гетерогенной системе; п — число молей какого-либо из получающихся при реакции веществ; V — объем системы; t — время; S — площадь поверхности фазы, на которой протекает реакция; Δ — знак приращения (Δп = п2 — п1;Δt= t2— t1). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
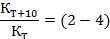
 ;
; 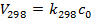
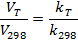
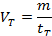
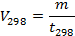
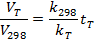
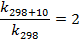
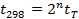
 ( минус перед всей дробью)
( минус перед всей дробью) приводит к тому, что температурная зависимость константы скорости отличается от уравнения Аррениуса. Поскольку энергия активации по Аррениусу рассчитывается как тангенс угла наклона логарифмической зависимости скорости реакции от обратной температуры, то проделав то же самое с уравнением
приводит к тому, что температурная зависимость константы скорости отличается от уравнения Аррениуса. Поскольку энергия активации по Аррениусу рассчитывается как тангенс угла наклона логарифмической зависимости скорости реакции от обратной температуры, то проделав то же самое с уравнением 