
|
|
Диаграммы состояния двухкомпонентной системы с неограниченной растворимостью компонентов в твёрдом и жидком состояниях.
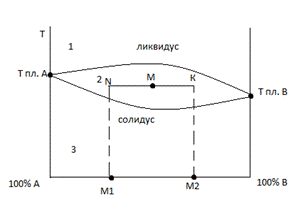
Солидус – линия начала плавления Ликвидус – линия начала кристаллизации Ф – фаза – совок.гомогенных частей, обладающих одинаковым составом и одними термодинамическими свойствами (∆Н, ∆S) К – компонент индивидуальное химическое вещество, которое является составной частью системы, может существовать самостоятельно. С =К-Ф+n, где n число термодинамических параметров (t, p) Анализ: К=2, А и В ТА>TВ 1 поле: К=2 Ф=1 (расплав) С=2-2+1=1 (Т, состав) 2 поле: К=2 ф=2 (кристаллы + расплав) С = 2-2+1=1 (Т) т.М – можно определить состав в этой точке М1 – состав кристаллической фазы, М2 – состав расплава Массовое соотношение кристаллов к массе расплава на половину рачага 3 поле: К=2 Ф=1 С=2-1+1=2 Диаграмма – графическое изображение зависимости р от Т, либо р от состава или Т от состава и др. – называется диаграммой составления системы. Анализ диаграммы позволяет определить число фаз в системе, границы составов, характер взаимодействия компонентов в системе, наличие образовавшихся соединений.
27.Трёхкомпонентные жидкыесистемы.Построение треугольных диаграм и определение состава смесей по данным диаграммы. Жидкие трехкомпонентные системы могут состоять как из жидкостей, дающих растворы любого состава, так и взаимно ограниченно растворимых. В последнем случае на диаграмме появляется область расслаивания. Фигуративной точке системы, лежащей внутри этой области, соответствуют две фигуративные точки двух растворов, на которые распадается система. Взаимная растворимость трех жидкостей зависит от температуры, и в ряде случаев при соответствующей критической температуре наступает неограниченная взаимная растворимость всех трех компонентов. Состав трехкомпонентной системы обычно изображают, пользуясь треугольником Гиббса – Розебома Вершины равностороннего треугольника отвечают чистым компонентам (100%) A, B и C. Каждая из сторон треугольника позволяет описать составы двухкомпонентных систем A + B, B + C, A + C. Все точки внутри треугольника описывают составы трехкомпонентных систем. Метод определения состава по Гиббсу основан на том, что сумма перпендикуляров, опущенных из любой точки равностореннего треугольника на каждую из сторон, равна высоте треугольника. Если принять, что высота треугольника соответствует 100 мольным (или массовым) процентам, то состав тройной системы можно выразить с помощью длин перпендикуляров. При этом содержанию данного компонента отвечает длина перпендикуляра, опущенного на сторону, противоположную соответствующей вершине треугольника. Например, точка о отвечает составу: 20% компонента A 30% компонента B и 50% компонента C. Длина перпендикуляра оценивается с помощью координатной сетки, покрывающей треугольник. Высоты треугольника делятся на 10 или 100 равных отрезков и через точки деления проводятся три группы параллельных прямых так, что каждая группа перпендикулярна соответствующей высоте треугольника, при этом длина каждого получающегося отрезка отвечает 10 или 1% содержания данного компонента в смеси.
28.Идеальные растворы жидкостей в жидкостях.ЗаконРауля.Положительные и отрицательные от закона Рауля.Состав жидкости и пара находящихся в равновесии с друг с другом.Растворы жидкостей в жидкостях, не дающие отклонений от закона Рауля, называются идеальными растворами. Для подавляющего большинства растворов жидкостей в жидкостях наблюдаются отклонения ( положительные или отрицательные) от закона Рауля Идеальные растворы- р-ры подчиняющиеся з-ну Рауля и Вантгофа, при образовании кот не меняется тепловой эффект или не изменяется объем. З-н Рауля – давление насыщенного пара над раствором, равно произведению давления пара над чисты растворителем на мольную долю растворителя. Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями. Противоположный случай, когда парциальные давления паров компонентов оказываются меньше вычисленных — отрицательные отклонения. Равновесие в системе жидкость и пар характеризуется определенным давлением насыщенного пара, это давление зависит от природы жидкости и температуры.
29Понижение давления пара над раствором.Связь между понижением давления пара и температурой замерзания раствора.Криометрический метод определения молярной массы растворенного вещества. Понижение давления над раствором- одно из следствий из з-на Рауля. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. Т.оПонижение давления насыщенного пара влечет за собой понижение температуры замерзания раствора по сравнению с чистым растворителем. При этом понижение температуры замерзания раствора ∆Тзам не зависит от природы растворенного в-ва и определяется лишь соотношением числа частиц растворителя и растворенного вещетва ∆Тзам = Kз b(X) b(X) – моляльная концентрация, моль \ кг Kз – Криометрическая константа, численно равная понижению температуры замерзания одномоляльного раствора, кг К \ моль b(X) = (1000 mр.в.) \ (М mр-ль) Тзам р-ра = Тзам р-ля - ∆Тзам Кз зависит только от природы растворителя и не зависит от природы растворенного вещества. По понижению температуры замерзания можно рассчитать молярную массу растворенного вещества, неэлектролита. M = (1000 Кзmр.в. ) \ (∆Тзамmр-ль)
30. связь между понижением давления пара и температурой кипения раствора..эмубулиометрическийметод.Понижениедавления над раствором- одно из следствий из з-на Рауля. Понижение давления насыщенного пара влечет за собой понижение температуры замерзания и повышение температуры кипения раствора по сравнению с чистым растворителем. ∆Ткип = Kэ b(X) b(X) – моляльная концентрация, моль \ кг Kэ – Эбулиометрическая константа, численно равная повышению температуры кипения одномоляльного раствора, кг К \ моль b(X) = (1000 mр.в.) \ (М mр-ль) Ткип р-ра = Ткип р-ля + ∆Ткип Молярные массы (кг \ моль) растворенных веществ – неэлектролитов могут быть рассчитаны по следующим формулам: M = (1000 Кэmр.в.) \ (∆Ткипmр-ль) Кэ зависит только от природы растворителя и не зависит от природы растворенного вещества.
31.Осмотическое давлениерастворов неэлектролитов и электролитов.Закон Вант-Гоффа.Изо-,гипо- и гипертонические растворы.Осмометрический метод определения мол.массы.Осмос – это процесс одностороннего перехода молекул растворителя в р-р или молекул растворителя с меньшей концентрацией в р-р с большей. Осмотическое давление – это избыточное явление, которое нужно приложить к системе, чтобы прекратить в ней осмос. Осмотическое давление зависит от кол-ва в-ва в р-ре и определяется з-ом Вант –Гоффа Уравнение Вант-Гоффа показывает, что осмотическое давление равно тому давлению, которое производило бы растворенное в-во, если бы оно в виде идеального газа занимало тот же объем, что и в р-ре при той же температуре. Π=сRT, где π- осмотическое давление (Росм) изотонический р-р- раствор, осмотическое давление которого равно осмотическому давлению плазмы крови; например, 0,9 % водный раствор хлорида натрия, 5 % водный раствор глюкозы. Гипотонический раствор, осмотическое давление которого ниже нормального осмотического давления плазмы крови. Гипертонический раствор, осмотическое давление которого выше нормального осмотического давления плазмы крови. С= m/MV, M=mRT/PосмV
32.проводники второго рода.удельная и молярная электропроводность и их изменение концентрацией.причиныизмененияК проводникам второго рода относят в-ва, проводящие электрический ток с помощью ионов (электролиты). Электропроводность L– это ток, проходящий через образец при приложении к нму единичной разности потенциалов ∆φ. G=i/∆φ=i/U, где ∆φ= U- напряжение единица измерения – Сименс – «См» Удельная электропроводность χ называют величину, численно равную току, который протекает через единицу площади образца при приложении к нему электрического поля единичной напряженности ε: χ =1/ρ, где ρ– удельное сопротивление. Ед.измер – Ом-1 см-1 Зависит: от концентрации, природы ионов, от температуры. Молярная электропроводность (λ) представляет собой проводимость объема, содержащего 1 моль эквивалента. λ= χ /с, где с- молярная концентрация р-ра в СИ: Ом-1м2моль-1 33.Абсолютная скорость движения.Молярная электропроводность при бесконечном разведении.законКольрауша.Абсолютная скорость движения иона – это скорость передвижения иона к электроду, отнесенная к единице напряженности электрического поля.Скорость движения ионов в растворе зависит от их природы, температуры и природы растворителя. Скорость иона при градиенте потенциала, равном единице, принято называть абсолютной подвижностью:КОЛЬРАУША ЗАКОН: в бесконечно разбавленном р-ре электролита перенос электричества осуществляется всеми ионами независимо друг от друга. Вследствие этого общая молярная электрич. проводимость такого р-ра ° равна сумме электрич. проводимостей °i отдельных ионов, а разность молярных электрич. проводимостей двух р-ров солей с общим катионом не зависит от природы этого катиона, При увеличении концентрации р-ра вследствие взаимод. ионов их движение уже не является независимым и Кольрауша закон не выполняется. Практич. использование Кольрауша закона состоит в нахождении ° р-ров слабых электролитов. Для этого привлекают данные о проводимости разб. р-ров сильных электролитов, к-рые полностью диссоциируютна те же ионы, что и изучаемый слабый электролит. 34.Кондуктометрическое измерение степени и константы и т.д. Кондуктометрия – метод физико-химического анализа, основанный на измерении электропроводности растворов. Она обладает рядом преимуществ перед химическими методами анализа, так как позволяет определять содержание индивидуального вещества в растворе простым измерением электропроводности раствора. Кондуктометрическтий метод анализа – один из наиболее точных способов определения растворимости труднорастворимых соединений. Он основан на измерении электропроводности жидкой фазы, находящейся в равновесии с соответствующим твердым соединением. Кондуктометрия используется также для определения констант равновесия химических реакций в растворах, констант диссоциации слабых электролитов. Для определения константы диссоциации слабого электролита измеряют «æ» ряда растворов, вычисляют их эквивалентные электропроводности Вычисленная практическая Кдисс зависит от концентрации. Независимой от концентрации является термодинамическая константа диссоциации, выраженная через активности ионов и молекул.
35. Кондуктометрическое титрование (его иногда называют также просто кондуктометрией) – это процедура, основанная на изменении электрической проводимости растворов при химических реакциях, при которых концентрация ионов различной подвижности меняется. Этот метод электрохимического анализа применим в водно-органических, водных и неводных средах. Соответствующие кривые титрования, наглядно демонстрирующие зависимость электропроводности от количества добавляемого реагента (титранта), как правило, имеют характерный излом в точках эквивалентности. При кондуктометрическом титровании смеси различных электролитов количество изломов будет таким образом равно количеству определяемых компонентов, способных вступить во взаимодействие с титрантом. По своей форме кривые могут различаться. Кондуктометрическое титрование в современных условиях основывается на различных реакциях. Самое широкое применение получили кислотно-основные взаимодействия. Метод характеризуется высокой чувствительностью, достаточно высокой точностью и простотой методик.
36.Механизм возникновения электродного потенциала.УравнениеНернста.Клас-цияэлектродов.Измерение электродных потенциалов. электродный потенциал – разность потенциалов возникающих на границе твердое тело и р-р, его величина зависит от природе металла. Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
где φ0 – стандартный электродный потенциал R – универсальная газовая постоянная 8,31 T- абсолютная температура n – число моль электронов F – постоянная Фарадея 96500 Men+ - активность металла Выражает зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах. Классификация электродов Электроды первого рода К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
Электроды второго рода Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
Электроды сравнения Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения. В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды. Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом: Рt, Н2 / Н+ Электрохимическое равновесие на электроде можно рассматривать в следующем виде: 2Н+ + 2е- ––> Н2 Потенциал водородного электрода зависит от активности ионов Н+ в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н+ 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
Каломельный электрод. Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2: Нg / Нg2Сl2, КСl Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
Хлорсеребряный электрод. В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора: Аg / АgСl, КСl Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах. Индикаторные электроды. Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды. Хингидронный электрод, относящийся к классу окислительно-восстановительных электродов (см. ниже), представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 – соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода: С6Н4О2 + 2Н+ + 2е- ––> С6Н4(ОН)2 Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
Стеклянный электрод, являющийся наиболее распространенным индикаторным электродом, относится к т.н. ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону. Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны. Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н+) выражается уравнением
Необходимо отметить, что стандартный потенциал ε°ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.3.5.5 Окислительно-восстановительные электроды В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe3+ до Fe2+ за счет электронов, полученных от платины, либо окисление ионов Fe2+ до Fe3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом. Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода: Pt, H2 / 2H+ // Fe3+, Fe2+ / Pt Зависимость потенциала редокс-электрода εRO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице. В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции Ох + ne- ––> Red, а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода Ох + ne- + mH+ ––> Red, уравнение Нернста будет записываться следующим образом:
При составлении гальванических элементов с участием редокс-электрода электродная реакции на последнем в зависимости от природы второго электрода может быть либо окислительной, либо восстановительной. Например, если составить гальванический элемент из электрода Pt / Fe3+, Fe2+ и второго электрода, имеющего более положительный электродный потенциал, то при работе элемента редокс-электрод будет являться анодом, т.е. на нем будет протекать процесс окисления: Fe2+ ––> Fe3+ + e- Если потенциал второго электрода будет меньше, чем потенциал электрода Pt / Fe3+, Fe2+, то на последнем будет протекать реакция восстановления и он будет являться катодом: Fe3+ + e- ––> Fe2+ Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал. Измерение электродного потенциала осуществляют с помощью систем, состоящих из двух электродов. Один из них - индикаторный ( стеклянный, платиновый) электрод - чувствителен к ионам, присутствующим в растворе, и потенциал, возникающий на кем, зависит от концентрации ионов в испытуемом растворе. Другой электрод - электрод сравнения ( каломельный или хлорсеребряный) - не чувствителен к ионам раствора, потенциал его постоянен.
37 Термодинамика гальванического элемента.Изменение изобарного потенциала и электродвижущая сила гальванического элемента.Гальванический элемент-это электрохимическая система, в которой химическая энергия окислительно-восстановительных реакций непосредственно превращается в электрическую. Условием работы гальванического элемента является разделение сопряженного окислительно-восстановительного процесса на два пространственно разделённых акта – окисления и восстановления. Любой гальванический элемент содержит по крайней мере два электрода, каждый из которых характеризуется электродным потенциалом. Разность потенциалов при разомкнутой внешней цепи называется электродвижущей силой гальванического элемента (э.д.с.). Электродвижущая сила всегда является положительной величиной и представляет собой разность между потенциалом положительно заряженного электрода и потенциалом отрицательно заряженного электрода: φ+ - потенциал положительно заряженного электрода, В; φ- - потенциал отрицательно заряженного электрода, В. Величина электродвижущей силы не зависит от конструкции элемента, а определяется только изменением энергии Гиббса для химической реакции, протекающей в элементе: ΔG = - zFE, (1.16) где ΔG – изменении е энергии Гиббса, Дж; z – число электронов, участвующих в окислительно-восстановительной реакции, протекающей в элементе; F - число Фарадея,Кл Е – электродвижущая сила, В. Поскольку электродвижущая сила всегда является положительной величиной, то из уравнения следует, что в гальваническом элементе всегда протекает самопроизвольная химическая реакция, для которой ΔG < 0. С другой стороны в соответствии с уравнением Гиббса-Гельмгольца имеем: ΔG = ΔН – ТΔS (1.17) Изменение энтропии выражается через изменение энергии Гиббса: ΔS = Cчитая, что Р = Const, уравнение (8.18) можно записать в виде: ΔS = zF После подстановки (8.16) и (8.17) в (8.18) и преобразований получим: ΔН = - zF(E – T где Температурный коэффициент может быть рассчитан по приближённому уравнению:
где Е1 и Е2 – электродвижущая сила гальванического элемента при температурах Т1 и Т2. Если химическая реакция в гальваническом элементе протекает в стандартных условиях, то стандартное изменение энергии Гиббса для реакции определяется соотношением: ΔG0 = - zFE0, (8.22) где Е0- стандартная э.д.с. гальванического элемента. Тогда константа равновесия химической реакции, протекающей в гальваническом элементе, будет определяться уравнением: lnКр = -
Ме1 + Ме то элекетродвижущая сила связана с с активностью (концентрацией) ионов уравнением: E = E0 - ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
Пользуясь этими соотношениями и таблицей стандартных электродных потенциалов, можно предсказать возможность осуществления многих окислительно-восстановительных реакций. 38. Нормальный водородный электрод представляет собой платиновую пластину, погруженную в однонормальный раствор сильной кислоты, насыщенный молекулярным водородом ( Рн, 1 атм) при 25 С Стандартный электродный потенциал (нормальный электродный потенциал) — потенциал электрода в растворе, в котором ионы, определяющие электродный процесс, имеют активность, равную единице. Величина Стандартного электродного потенциала измеряется относительно нормального водородного электрода, потенциал которого условно принимается равным нулю. Измерение электродного потенциала осуществляют с помощью систем, состоящих из двух электродов. Один из них - индикаторный ( стеклянный, платиновый) электрод - чувствителен к ионам, присутствующим в растворе, и потенциал, возникающий на кем, зависит от концентрации ионов в испытуемом растворе. Другой электрод - электрод сравнения ( каломельный или хлорсеребряный) - не чувствителен к ионам раствора, потенциал его постоянен. 39. Клас-цияэлектродов.Электроды первого рода К электродам первого рода (обратимы относительно либо катиона, либо аниона. Металлические электроды, обратимые отностельно катионов – это электрды, у которых металл опущен в р-р хорошо растворимой соли этого металла. Газовые электроды, обратимые относительно анионов, обычно образуются про опускании инертного металла, насыщенного газом, в р-р хорошо растворимого электролита, анионом которого является восстановленная форма газа.) относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. Электродами второго рода (обратимы относительно аниона и аниона) являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды сравнения электрод с точно известным потенциалом – электрода сравнения. В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды. Индикаторные электроды. Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе потенциометрическим методом В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 , степень диссоциации
, степень диссоциации  и
и  . Либо пользуются уравнением
. Либо пользуются уравнением  , полученным из предыдущего. Эквивалентную электропроводность раствора вычисляют по справочным данным λ0=λ0+ + λ0-
, полученным из предыдущего. Эквивалентную электропроводность раствора вычисляют по справочным данным λ0=λ0+ + λ0- ,
, 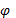 - электродный потенциал
- электродный потенциал (III.40)
(III.40) (III.48)
(III.48) (III.49)
(III.49) (III.50)
(III.50) (III.51)
(III.51) (III.52)
(III.52) (III.53)
(III.53) (III.54)
(III.54) (III.55)
(III.55)
 =
=  = zF
= zF 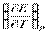 (1.18)
(1.18) (1.19)
(1.19)

 =
=  , (1.21)
, (1.21) =
=  (1.23)
(1.23)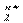 = Me2 + Me
= Me2 + Me  , (1.24)
, (1.24) ln
ln  (1.25)
(1.25)
