|
|
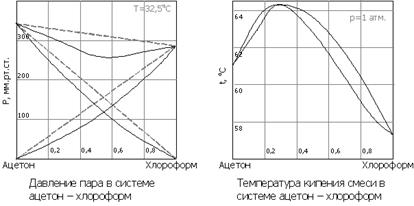
Диаграммы плавления бинарных систем. Понятие о физико-химическом анализе /С.Н. Курнаков/. Термический анализ. Принципы непрерывности и соответствия.Принцип непрерывности : непрерывное изменения параметров системы сопровождается непрерывным изменением свойств определенных фаз. Принцип соответствия : каждому компоненту соответствует геометрический образ на диаграмме. Термический анализ, совокупность методов определения температур, при которых происходят процессы, сопровождающиеся либо выделением тепла (например, кристаллизация из жидкости), либо его поглощением (например, плавление, термическая диссоциация). 23)Растворимость жидкостей в жидкостях. Верхняя и нижняя критические температуры растворения. Работы В. Ф Алексеева по взаимной растворимости жидкостей.\При смешивании двух жидкостей можно наблюдать самую различную их взаимную растворимость: от практически полной нерастворимости друг в друге (ртуть - вода) до неограниченной смешиваемости (ацетон - вода). Неограниченно растворяются в воде все жидкие неорганические кислоты (HNO3, HClO4, HCN, HNCS, и др.), простейшие органические кислоты (НСООН, СН3СООН и др.), простейшие спирты и кетоны (СН3ОН, С2Н5OН, СН3СОСН3 и др.). Если жидкости растворяются друг в друге ограниченно, то происходит их расслаивание с образованием двух жидких фаз, причем фаза с большей плотностью будет находиться внизу. Соприкасающиеся слои жидкостей находятся в фазовом равновесии, и каждый слой представляет собой насыщенный раствор одной жидкости в другой при данной температуре. Если в систему, включающую две несмешивающиеся жидкости, ввести некоторое третье вещество, то это вещество будет распределяться между двумя жидкими фазами и концентрироваться в той из них, в которой оно больше растворимо. В 1876 году Алексеев описал способ определения взаимной растворимости жидкостей, названный его именем, и указал на существование критической температуры растворения. В 1883 году разработал теорию, согласно которой молекулы в растворах находятся в агрегированном состоянии; эти представления сыграли важную роль в создании теории поверхностного натяжения. С 1886 года Алексеев разрабатывал аналитические и калориметрические методы испытания каменных углей, торфа и глин. Согласно правилу В. Ф. Алексеева (1886 г.), при разделении соединительных линий фазовой диаграммы пополам точки деления ложатся на общую прямую, которая заканчивается в критической точке растворения (прямая еК). Это правило позволяет дополнить экспериментальные данные о взаимной растворимости жидкостей, а также найти состав в критической точке по известным значениям tкр 24)Состав жидкости и пара, находящихся в равновесии друг с другом. З-ны Коновалова.Диаграммы: состав – давление насыщенного пара и состав – температура кипения. Правило рычага. Азеотропные смеси и их разделение. Первый закон Коновалова (1881 г.) описывает процесс фракционной перегонки: насыщенный пар по сравнению с равновесным раствором обогащён компонентом, добавление которого к системе повышает общее давление пара Рассмотрим фазовую диаграмму при постоянном давлении для бинарной системы в координатах состав — температура:
Последовательные перегонки в промышленных условиях объединены в один автоматизированный процесс в дефлегмационных и ректификационных колоннах. Второй закон Коновалова (1881 г.) описывает растворы с отклонениями от свойств идеальных растворов и объясняет существование азеотропных растворов, состав которых при перегонке не изменяется: Экстремумы на кривых полного давления пара отвечают такому равновесию раствора и насыщенного пара, при котором состав обеих фаз одинаков
25)Перегонка. Перегонка с водяным паром. Фракционная перегонка. Перегонка. – называется операция, очень частоприменяемая в химической лабораторной практике и в технике на заводахдля разделения растворов жидкостей или твердых тел в жидкостях, а такжесмесей их, основанная на неодинаковой их летучести и состоящая впревращении жидкости кипячением в пар, который затем охлаждением вхолодильнике вновь сгущается в жидкое состояние. Перегонка с водяным паром является эффективным методом очистки органических соединений, не растворимых или трудно растворимых в воде. Она особенно пригодна в тех случаях, когда продукт реакции загрязнен большим количеством труднолетучих смолистых примесей. Этот способ позволяет проводить перегонку веществ при температуре, значительно меньшей, чем их температура кипения. Фракционная перегонка (дистилляция) – способ разделения смеси жидких веществ, основанный на различной температуре кипения компонентов смеси. При этом отогнанный дистиллят обогащается низкокипящим компонентом, а остаток – высоко кипящим. При этом виде перегонки используется дефлегматор, в котором при неполном охлаждении пара кипящей жидкости происходит частичная конденсация пара более высоко кипящей жидкости, обогащенный высоко кипящим компонентом промежуточный дистиллят (флегма) возвращается в колбу, а пар обогащается более низкокипящим веществом. При этом фракционная перегонка позволяет эффективно разделять смеси веществ с небольшой разницей в температурах кипения (~10-20 °C).

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
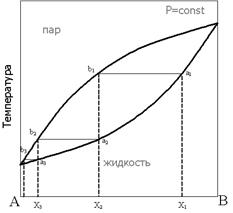 При нагревании исходной смеси состава Х1 кипение начнётся в точке а1. При этом состав первых порций пара соответствует точке b1. При конденсации этого пара образуется смесь состава Х2, в которой доля компонента А выше, по сравнению с исходной смесью. Нагрев этой смеси приведёт к получению конденсата состава Х3 и так далее, вплоть до выделения чистого компонента А. Отметим, что при кипении смеси состава Х1 состав жидкости будет обогащаться компонентом В, соответственно температура кипящей жидкости будет повышаться до тех пор, пока в жидкости не останется только компонент В.
При нагревании исходной смеси состава Х1 кипение начнётся в точке а1. При этом состав первых порций пара соответствует точке b1. При конденсации этого пара образуется смесь состава Х2, в которой доля компонента А выше, по сравнению с исходной смесью. Нагрев этой смеси приведёт к получению конденсата состава Х3 и так далее, вплоть до выделения чистого компонента А. Отметим, что при кипении смеси состава Х1 состав жидкости будет обогащаться компонентом В, соответственно температура кипящей жидкости будет повышаться до тех пор, пока в жидкости не останется только компонент В.