
|
|
Задачи ко второму учебному модулю
Задача № 1. Оцените максимально возможную концентрация растворенного О2 в воде при 25оС, если константа Генри равна 2 . 10–8 моль/л. Полученную величину сравните с нормируемой для природных вод и укажите причины в различии полученных значений. Задача № 2. Оцените величину рН атмосферных осадков при растворении в них атмосферного СО2. Влиянием других кислых газов пренебречь. В оценках принять константу диссоциации угольной кислоты:
Задача № 4. Оцените концентрацию карбонат-иона при растворении атмосферного СО2 в природных водах при температуре 25оС. В оценках принять: константа Генри КГ = 3,4 . 10–7 моль/ л . Па; К1 = 4,5 . 10–7 моль/л; К2 = 4,7 . 10–7 моль/л; рН = 10. Задача № 5. Рассчитайте концентрацию бикарбонат-иона при растворении атмосферного СО2 в природных подах при 20оС. В качестве справочных данных принять: количество СО2 в атмосфере составляет 0,0343% (объемных), константа Генри КГ = 3,4 . 10–7 моль/ л . Па; К1 = 4,5 . 10–7 моль/л; К2 = 4,7 . 10–7 моль/л; рН = 7. Задача № 6. Оцените, какой объем воды условно потеряет кислород, если в замкнутый водоем в результате аварии попало 100 кг бензола. Константа Генри равна 1,26 . 10–8 моль/л . Па. Задача № 7. Что произойдет с популяцией парка в замкнутом водоеме, если в последний произошел залповый выброс фенола в количестве 20 кг? Равновесная концентрация растворенного в воде О2 до выброса составляла 10 мг О2/л. Объем водоема 10000 м2. Задача № 8. Оцените последствия для популяции рыб замкнутого водоема, если в последний начали сбрасывать сточные воды крахмалопаточного завода. В сточных водах содержится 60 мг/л сахаров (С12Н22О11). Мощность сброса за контрольный период составила 1000 м3. Равновесная концентрация О2 в водоеме до сброса сточных вод – 9 мг/л, объем водоема – 10000 м3. Задача № 9. Оцените максимально возможное количество биомассы, которое может быть получено при фотосинтезе в случае отсутствия поступления в водоем других углеродсодержащих соединений, в том число и СО2, если в процессе фотосинтеза величина рН среды изменилась с 7 до 10 единиц. В оценках принять: при рН = 7, щелочность 1 мг-экв/л, а при рН = 10 щелочность – 4 мк-экв/л, К1 = 4,47 . 10–7 моль/л; К2 = 4,68 . 10–11 моль/л; рН = 10. Задача № 10. Постройте диаграмму 1) Fe3+ + 2) Fe(OH)2 (тв) ® Fe2+ + 2OH–, k2 = 2 . 10–15; 3) Fe(OH)3 (тв) ® Fe3+ + 3OH–, k3 = 6 . 10–38; 4) Fe(OH)3 (тв) + Оцените основные формы нахождения соединений железа в поверхностных и придонных слоях воды, если средняя глубина водоема составляет 12 м. Задача № 11. Определите основную форму нахождения Al в поверхностных слоях воды водоема при значении рН = 5 и рассчитайте его содержание в этой форме, если образование растворимых форм алюминия в природных водах ограничить следующими реакциями: 1) Al(OH)3 + 3H+ ® Al3+ + 3H2O, k1 = 5,1 . 109; 2) Al(OH)3 + H+ ® Al(OH)2+ + H2O, k2 = 4 . 101; 3) Al(OH)3 + H2O ® Al(OH)4– + H+, k3 = 1 . 10–14. Задача № 12. Оцените величину рН дождей в промышленном районе, где основной вклад в закисление атмосферной влаги дает SO2. Парциальное давление SO2 в атмосфере равно 5 . 10–9 Па, константа Генри равна 5,4 моль/л . атм, а константа скорости диссоциации сернистой кислоты – 2,7 . 10–2 моль/л. Задача № 13. Что произойдет с популяцией карпа в замкнутом водоеме, если в последний произошел залповый сброс фенолов в количестве 25 кг. Равновесная концентрация растворенного кислорода в воде до сброса составляла 8 мг O2/л, объем водоема – 10000 м3. Оцените максимальный уровень загрязнения воды в водоеме. Задача № 14. Средние концентрации неорганических соединений азота и фосфора в озере Вазель Южского района ивановской области в 1996 г. составили, г/м3: 1) аммоний солевой – 1,21; 2) нитрит – 0,12; 3) азот нитратов – 2,0; 4) фосфаты (в пересчете на Р) – 0,235. Содержание хлороформа в этот же период времени колебалось в пределах 34-60 мг. Средняя глубина озера равна 1 м. Рассчитанная средняя плотность потоков из донных отложений неорганического азота и фосфора составляет, соответственно, 1,5 и 0,7 г/м2 . год. Во-первых, обоснуйте оптимальное соотношение азота и фосфора в природных водах, это значение сравните с экспериментальными и сделайте соответствующие выводы. Во-вторых, рассчитайте время оборота азота и фосфора в системе вода – донные отложения и сделайте выводы о развитии процессов эвтрофирования. В-третьих, оцените категорию трофического состояния озера Вазаль. Задача № 15. Определите форму нахождения соединений железа в воде, если последняя характеризуется следующими показателями: рН = 7, ре = 10 (концентрация железа в воде 10–4 моль/л). Задача № 16. Оцените максимальную концентрацию 2,3,7,8-тетрахлорбензопарадиоксина (ТХДД) в воде, если его содержание в атмосферном воздухе составляет около 0,13 мг/м3, константа генри равна 0,2 моль/л . Па. Оцените возможные каналы выведения ТХДД из природных вод.
ОТВЕТЫ НА ЗАДАЧИ для самостоятельного решения
2.СО2(1000)М(0,1/0,97) (l/30)[SO4(62,6)HCO3(18,8)Cl(18,6)]/[Na(39,5)Ca(30,4)Mg(30,l)];19.рН = 11,4;20.Щ = 5,48 . 10–3 моль/л; Ж = 5,48 . 10–3 моль/м3; 21.рН = 9,3; 22.h = 0,18 м за 1000 лет; 23.См. штриховые линии на рис. 13; 24.
ЛИТЕРАТУРА
1. Андруз Дж., Бримблекумб П., Джикелз Т., Лисс П. Введение в химию окружающей среды. Пер. с англ. – М.: Мир, 1999. – 271 с. 2. Исидоров В.А. Экологическая химия: Учебное пособие для вузов. – СПб.: Химиздат, 2001. – 304 с. 3. Гусакова Н.В. Химия окружающей среды. Серия «Высшее образование». – Ростов-на-Дону: Феникс, . – 192 с. 4. Исидоров В.А. Введение в химическую экотоксикологию: Учебное пособие для вузов. – СПб.: Химиздат, 1999. – 144 с. 5. Мур Док., Рамамурти С. Тяжелые металлы в природных водах: контроль и оценка влияния: Пер. с англ. – М.: Мир, 1987. – 287 с. 6. Экологическая химия. Под ред. Ф. Корте. Пер. с англ. – 2004. – 396 с. 7. Человек и его среда обитания. Под ред. Г.В. Лисичкина и Н.Н. Чернова. – 2004. – 460 с. 8. Хенсе М., Харренмойс П., Янсен Е., Арвин Э. Очистка сточных вод. Под ред. Л. Дернера. Пер. с англ. – 2004. – 400 с. 9. Гидрохимические показатели состояния окружающей среды. Справочные материалы / Под ред. Т. В. Гусевой. – М.: Социально-экологический союз, 2000. – 148 с.
ПРИЛОЖЕНИЕ Таблица 2.Равновесные парциальные давления паров воды в воздухе при различных температурах
Таблица 3.Константы Генри (Кг) для некоторых газов при температуре 298 К
Таблица 4.Константы Генри (KГ) для кислорода при различных температурах
Таблица 5. Изменение стандартной энергии Гиббса ( при образовании некоторых веществ и ионов в водном растворе при давлении 101,3 кПа и температуре 298 К
Таблица 6.Изменение стандартной энтальпии ( при образовании некоторых веществ и ионов в водном растворе при давлении 101,3 кПа и температуре 298 К
Таблица 7.Константы диссоциации угольной и сернистой кислот по первой (К1)и второй (К2)ступеням диссоциации при различных температурах
Таблица 8.Константа а, характеризующая радиус гидратированного иона в модифицированном уравнении Дебая – Хюккеля при давлении 101,3 кПа и температуре 298 К (А = 0,5058; В = 0,3281 . 108)
ОГЛАВЛЕНИЕ

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Н2СО3 Н+ + НСО3–.
Н2СО3 Н+ + НСО3–. Задача № 3. Оцените рН дождей в г. Иваново, где основной вклад в закисление атмосферной влаги (уменьшение рН) дает диоксид серы. Средняя концентрация диоксида серы в приземном слое воздуха составляет 30 мкг/м3, константа Генри равна 5,4 моль/(л . атм), а константа скорости диссоциации (Н2SО3 Н+ + НSО3–) составляет 2,7 . 10–2 моль/л. Выполните аналогичные расчеты для г. Череповца, где средняя концентрация SO2 достигает 1 мг/м3. Рассчитайте парциальные индексы загрязнения атмосферы в двух городах и сделайте соответствующие выводы.
Задача № 3. Оцените рН дождей в г. Иваново, где основной вклад в закисление атмосферной влаги (уменьшение рН) дает диоксид серы. Средняя концентрация диоксида серы в приземном слое воздуха составляет 30 мкг/м3, константа Генри равна 5,4 моль/(л . атм), а константа скорости диссоциации (Н2SО3 Н+ + НSО3–) составляет 2,7 . 10–2 моль/л. Выполните аналогичные расчеты для г. Череповца, где средняя концентрация SO2 достигает 1 мг/м3. Рассчитайте парциальные индексы загрязнения атмосферы в двух городах и сделайте соответствующие выводы. – рН для железа, если его среднегодовая концентрация в водоеме составляет 0,1 мг/л, а основные равновесия записываются следующим образом:
– рН для железа, если его среднегодовая концентрация в водоеме составляет 0,1 мг/л, а основные равновесия записываются следующим образом: ® Fe2+,
® Fe2+,  = 13;
= 13;
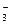
 ; 3. 28,3 г; 4. М = 34,3 г/л; класс вод с повышенной соленостью; 5. Гидрокарбонатные воды кальциевой группы третьего типа; 6. 1,28 . 10–4 моль; 7. Вторая вода более агрессивна; 8.Q = 0,22 < 1, следовательно, будет идти процесс растворения гипса; 9. Ангидрит более устойчив; 10.СF = 19,3 мг/л, что в 26 раз превышает ПДК; 11.Общая жесткость равна 7,8 . 10–2 моль/м3, что соответствует 0,22 немецких градусов жесткости, 0,39 французских градусов жесткости и 3,90 американских градусов жесткости; жесткость карбонатная равна 0,020 моль/м3, вода относится к группе очень мягких вод; 12.рН 6,9; DрН = 1,3; 13. рН 4,9; аСO2= +16%; aSО2= +93%; aNH3= –9%; 14. рН 5,7: SO
; 3. 28,3 г; 4. М = 34,3 г/л; класс вод с повышенной соленостью; 5. Гидрокарбонатные воды кальциевой группы третьего типа; 6. 1,28 . 10–4 моль; 7. Вторая вода более агрессивна; 8.Q = 0,22 < 1, следовательно, будет идти процесс растворения гипса; 9. Ангидрит более устойчив; 10.СF = 19,3 мг/л, что в 26 раз превышает ПДК; 11.Общая жесткость равна 7,8 . 10–2 моль/м3, что соответствует 0,22 немецких градусов жесткости, 0,39 французских градусов жесткости и 3,90 американских градусов жесткости; жесткость карбонатная равна 0,020 моль/м3, вода относится к группе очень мягких вод; 12.рН 6,9; DрН = 1,3; 13. рН 4,9; аСO2= +16%; aSО2= +93%; aNH3= –9%; 14. рН 5,7: SO 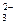 , HSO
, HSO  ; рН 4,5: HSO
; рН 4,5: HSO  = 0,49; 25.
= 0,49; 25.  )
) , кДж/моль
, кДж/моль
 , кДж/моль
, кДж/моль
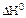 )
)