
|
|
Окислительно-восстановительные условияИ миграция элементов
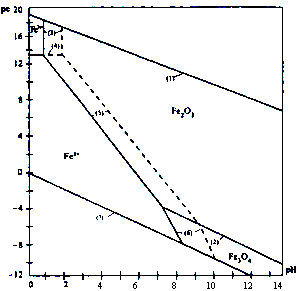
Некоторые рудные месторождения, особенно инфильтрационные месторождения урана с перемещающимся фронтом, являются следствием редокс-реакций в подземных водах. Интенсивность миграции элементов принято характеризовать коэффициентом водной миграции Кх,равным частному от деления количества элемента х в минеральном остатке природной воды на его содержание в горных породах, дренируемых этой водой: Кх = тх где mх – содержание элемента х в воде, мг/л; nх – содержание элемента х в породах, %; а – минерализация воды, мг/л. Чем больше величина Кх, тем больше миграционная способность данных элементов. Очень подвижные активные мигранты имеют значение Кх свыше 20, подвижные – от 20 до 1. Коэффициент водной миграции таких слабоподвижных мигрантов, как железо, титан и алюминий, не превышает 0,1. Изменение интенсивности миграции в одних и тех же условиях среды в зависимости от формы, в которой элемент содержится в породе, характеризуется коэффициентом контрастности миграции. Например, в различных обстановках миграция ионов Zn в сульфидной форме и в форме оксида имеет коэффициент контрастности миграции около 100. Одними из наиболее важных характеристик, существенным образом влияющих на миграцию элементов в ландшафтах, являются кислотно-основные и окислительно-восстановительные характеристики среды. Однако следует иметь в виду, что живые организмы способны в значительной степени трансформировать процессы миграции. Геохимический барьер – это участок зоны гипергенеза, где на коротком расстоянии происходит резкое уменьшение интенсивности миграции, что приводит к концентрированию химических элементов. Физико-химические барьеры возникают при резких изменениях величины рН или соотношения рН/Еh. Например, если кислородсодержащая вода начинает двигаться по водному горизонту, в котором первоначально существовали восстановительные условия, то между окислительной и восстановительной средами может образоваться редокс-фронт. Этот фронт будет перемещаться в направлении движения воды, но со значительно меньшей скоростью, чем вода. Скорость движения фронта определяется способностью водоносного горизонта (особенно содержащегося в нем органического вещества) потреблять кислород. Если типичный водоносный горизонт в осадочных породах содержал 1% реакционноспособного органического углерода, а подземная вода – 10 мг/л растворенного кислорода, то, согласно расчету, фронт должен мигрировать в 13000 раз медленнее, чем вода. Ряд элементов (особенно уран, селен, мышьяк, молибден) не растворимы в восстановительных условиях и растворимы в окислительных. При продвижении фронта окисления эти элементы, присутствующие в водоносном горизонте, растворяются. Движущиеся подземные воды переносят их через фронт в восстановительную среду, где они сразу же снова осаждаются. Таким образом, элемент, содержащийся во всем водоносном горизонте до прохождения фронта или перенесенный из других областей системы подземных вод, концентрируется в непосредственной близости к фронту, что создает возможность экономически выгодной его добычи. Примеры решения задач Пример 20. Постройте диаграмму Решение. Все области устойчивого существования соединений железа в рассматриваемой системе должны находиться между границами, определяющими устойчивое состояние воды. Уравнения, характеризующие верхнюю и нижнюю границы устойчивости воды, были рассмотрены ранее; начнем с границы Fe2O3-Fe3O4. Уравнение, описывающее это превращение, можно представить в следующем виде:
В случае, если оксиды железа (II) и железа (III)не содержат примесей, их активность может быть принята равной единице. В этом случае константа равновесия может быть выражена уравнением: K=1/[( Прологарифмируем это уравнение и выразим значение lgK = 2
На диаграмме эта граница является прямой с тангенсом угла наклона к оси абсцисс, равным –1. Точка пересечения с осью ординат задается величиной константы равновесия, которую можно определить, предварительно рассчитав DG0реакции, описывающей данную границу:
Следовательно, уравнение, определяющее границу, имеетвид:
Уравнение, описывающее превращение Fe3+ – Fе2О3, можнопредставить в виде:
Константа равновесия этого процесса имеет вид:
Логарифм константы равновесия равен:
Очевидно, что на диаграмме эта граница является прямой, параллельной оси рН = В ходе рассуждений, аналогичных проделанным ранее, легко вычислить, что lg Kравн = –2,23, откуда рН = 1,63. Граница между Fe3+ и Fe2+ задается уравнением
Выражения для константы равновесия и
Граница является прямой, параллельной оси рН. Соотношение активностей Граница Fe2O3 – Fe2+ определяется реакцией
Выражения для константы равновесия и
Вновь встает вопрос о выборе значения aFе2+. Если принять, что aFe2+ = aFe3+,то не нужно вычислять значение К, поскольку граница Fe2O3 – Fe3+ является прямой линией с тангенсом угла наклона, равным –3, проходящей через точку пересечения границ Fe2O3—Fe3+ и Fe3+—Fe2+. Однако при построении диаграмм рекомендуется все же вычислить Kравн и проверить, пройдет ли новая граница через точку пересечения двух других. Если три границы не встретятся в одной точке, это будет свидетельствовать об арифметической ошибке. Неточности в величинах энергии Гиббса привели бы к ошибочному положению точки пересечения, но точка в любом случае должна быть одна. Граница FезО4—Fe2+ описывается уравнением
Выражения для константы равновесия и
Вычисление Kравн не является необходимым, поскольку известен тангенс угла наклона (–4) и общая точка – пересечение границ Fe2O3—Fe2+ и Fe3O4—Fe2+. На рисунке 12 представлены в виде соответствующих отрезков прямых границы областей существования соединений железа в рассмотренной нами системе. Анализируя полученную диаграмму, можно сделать вывод о том, что Fe3+ является преобладающей формой только в крайне кислых средах, таких, например, которые имеют место вдренажных водах рудников. В щелочной среде железо должно быть нерастворимым при любых значениях Ответ: см. диаграмму на рисунке 12. Пример 21.На сколько единиц снизится редокс-уровень системы, определяемый верхней границей устойчивости воды, если парциальное давление кислорода в находящемся в равновесии с водой воздухе снизится с Р = 1 атм до: а) парциального давления, соответствующего средним значениям в приземном воздухе с относительной влажностью 90%, при температуре 298 К и общем давлении, равном 1 атм? б) в миллион раз? Какое значение будет иметь Решение.Верхняя граница устойчивости воды связана с возможностью протекания процесса ее окисления. Окислительно-восстановительная реакция, протекающая при этом, может быть представлена уравнением (81):
Рис. 12. Диаграмма
На диаграмме (рисунок 12) пунктирной линией обозначены границы, соответствующие активности ионов железа в растворе aFe2+ = аFез+ = 10–9 моль/л. Цифры в скобках соответствуют номерам следующих химических реакций: 1) 2) Fe2O3 + 2 3) Fe2O3 + 6Н+ = 2Fe3+ + 3H2O; 4) Fe3+ + 5) Fe2O3 + 2 6) 7) H+ + Зависимость величины редокс-потенциала системы от парциального давления кислорода в равновесном воздухе и от рН раствора описывается уравнением (87):
При парциальном давлении кислорода, равном 1 атм, и рН 7 значение
При относительной влажности 90% и температуре 298 К парциальное давление кислорода в приземном воздухе можно определить по уравнению:
где Робщ и j – относительная влажность воздуха; С При условиях а) рассматриваемого Примера
Значение
Для случая а) изменение
В случае б) значение
Для случая б) изменение D Ответ: в случае а) редокс-уровень системы изменится на 0,2 единицы Пример 22. Какое парциальное давление кислорода должно соответствовать редокс-уровню системы, в которой протекает анаэроб-ный процесс восстановления диоксида углерода до метана ( Решение. При установлении равновесия в системе редокс-потенциалы всех окислительно-восстановительных реакций должны быть равны друг другу. Поэтому окислительно-восстановительный потенциал реакции, определяющей верхнюю границу устойчивости воды (уравнение 87), будет равен окислительно-восстановительному потенциалу реакции восстановления диоксида углерода:
Из этого равенства легко найти
lg Ответ: парциальное давление кислорода в воздухе Пример 23.Какое максимальное количество мг органических веществ общей формулой {СН2О} может быть окислено за счет растворенного кислорода (при высоких значениях Решение. Процесс окисления органического вещества общей формулой {СН2О} можно представить следующим уравнением реакции: {СН2О}+ O2 ® СО2 + Н2О. В связи с отсутствием по условию Примера, дополнительного поступления кислорода максимальное количество органического вещества,которое может быть окислено в воде, будет определяться содержанием кислорода в воде, которое, в свою очередь, будет соответствовать условиям равновесия с воздухом, устанавливающимся до начала процесса окисления. При равновесии с приземным воздухом это количество кислорода составит (уравнение 1):
Парциальное давление кислорода для условий данного Примера составит (Пример 21):
Концентрация растворенного кислорода в воде составит:
= 2,63 . 10–4 (моль/л), или Количество органических соединений общей формулой {СН2О} (молярная масса которых равна 30 г/моль) можно определить по реакции окисления: mорг = Морг где Морг и
mорг = 30 . 8,4/32 = 7,9 (мг/л). Ответ: в каждом литре воды может быть окислено не более 7,9 мг органических соединений общей формулой {СН2О}. Пример 24.Какой объем природной воды, находившейся в равновесии с атмосферным воздухом, необходимо взять, чтобы после окисления 10 г сахара (среднее количество в стакане чая) содержание кислорода в этой воде составляло более 4 мг/л (количество, при котором рыбы еще не погибают)? Принять, что содержание кислорода в атмосферном воздухе соответствовало средней для приземного воздуха концентрации, температура была равна 298 К, общее давление – 101,3 кПа, парциальное давление паров воды – 3,1 . 103Па. Сахар имеет молекулярную формулу С12Н22O11. Решение. Поскольку в растворе после окисления сахара, по условию Примера, остается растворенный кислород, процесс окисления протекает при высоких значениях окислительно-восстановительного уровня системы и может быть представлен следующим уравнением: С12Н22О11 + 12О2 ® 12СО2 + 11Н2О. Количество кислорода (г), которое в этом случае потребуется для окисления сахара, составит:
где 12 – количество молекул кислорода, необходимое для окисления одной молекулы сахара; mсахара – количество сахара, вступившего в реакцию окисления;
По условию Примера, содержание кислорода в природной воде соответствует значениям, наблюдаемым при равновесии между водой и приземным воздухом. Эта величина составляет 8,4 мг/л. Поскольку, по условию Примера, остаточное содержание кислорода в воде не должно быть меньше 4 мг/л, на окисление сахара из каждого литра природной воды не должно расходоваться больше, чем
где
Определим минимальный объем природной воды, кислород из которой будет расходоваться на окисление сахара:
Ответ:необходимо взять не менее 2500 л природной воды. Пример 25.Какой минимальный объем природной воды необходим для растворения сероводорода, образовавшегося при окислении 10 г сахара в процессе сульфат-редукции, если весь выделившийся сероводород переходит в раствор, в котором концентрация H2S не превышает значений подпороговой концентрации, определяемой по запаху (ППКорг = 0,05 мг/л)? Сахар имеет молекулярную формулу C12H22O11. Решение.В процессе сульфат-редукции при окислении органического вещества происходит образование сероводорода по реакции: 2Сopг + SO На каждые два моля углерода, связанных в органическое соединение, образуется молекула сероводорода. Количество молей углерода (NC), содержащихся в m г органических соединений, имеющих молярную массу Морг и содержащих n атомов углерода в каждой молекуле органического соединения, можно определить по уравнению: NC = mn/Mорг. (V = m/M) Для условий Примера количество молей углерода, содержащихся в 10 г сахара (молекулярная формула C12H22O11), составит: NС= 10 . 12/342 = 0,35 (молей). В процессе сульфат-редукции этого количества молей углерода может образоваться NH2S молей сероводорода: NH2S = 1/2NC= 0,175 (молей). Масса образующегося сероводорода составит: mH2S =NH2S MH2S mH2S = 0,175 . 34 . 103 = 5950 (мг). Объем природной воды, необходимый для растворения этого количества сероводорода при конечной концентрации ниже ППКорг, составит: V = mH2S/ППKоpr = 5950/0,05 = 120000(л) = 120 (м3). Ответ: необходимый минимальный объем природной воды равен 120 м3.
Контрольные вопросы 1. Какие проблемы гидросферы вы отнесли бы к глобальным? Почему? 2. С какими аномальными свойствами воды связано влияние гидросферы на климат? 3. Как выразить концентрацию примесей в воде в промилле? 4. Дайте характеристику гидрологического цикла на суше и в океане. Что такое «бессточные» районы? 5. В каком виде может находиться вода в гидросфере? 6. Какие способы классификации природных вод вы знаете? 7. Какие единицы используются для выражения концентрации воды при записи еесостава в виде формулы Курлова? Как можно их рассчитатьисходя из концентрации, выраженной в процентах массовых? 8. Какие ионы и в каком количестве следует ожидать в атмосферных осадках: а) на побережье океана; б) в аридных зонах; в) в районах интенсивнойвулканической деятельности? 9. Сформулируйте закон Дитмара. Для решения каких практических задач он используется? 10. Назовите отличительные признаки грунтовых вод, артезианских под и верховодки. 11. Какие анионы и катионы, содержащиеся в природных водах, называют главными? Почему? 12. Какие природные источники поступления главных ионов в подземные воды вы знаете? 13. Как и почему по данным о минерализации природных вод можно предсказать их ионный состав? 14. Почему происходит изменение химического состава воды в реках по их течению? 15. Как на основании термодинамических данных оценить растворимость минералов в воде? Какие критерии устойчивости минералов вы знаете? 16. Что такое «агрессивность» природных вод? 17. Что такое «неустойчивость» минералов? 18. Для каких целей удобно использовать понятия: а) «агрессивности» природных вод; б) «неустойчивости» минералов? 19. В чем различие понятий «произведение растворимости» и «константа равновесия процесса растворения»? 20. Какую величину — произведение растворимости или константу равновесия процесса растворения — можно рассчитать на основании термодинамических данных? Какие термодинамические данные необходимы для выполнения этого расчета? 21. Как связаны между собой значения произведения растворимости и константы равновесия процесса растворения? 22. От каких физико-химических параметров системы зависит значение: а) произведения растворимости; б) константы равновесия процесса растворения? 23. Какие факторы, характеризующие природные системы, следует принимать во внимание при оценке константы равновесия процесса растворения? 24. Что такое жесткость воды и в каких единицах она измеряется? 25. Как классифицируют природные воды по величине жесткости? Какую жесткость имеют природные воды, наиболее широко представленные в вашей местности? 26. Какие компоненты входят в состав карбонатной системы природных водоемов? 27. Равновесия междукакими компонентами природных систем определяются законом Генри? 28. Какие параметры природных систем определяют величину константы Генри? 29. Какое значение рН должны иметь атмосферные осадки, если «активные» примеси в атмосферном воздухе представлены только диоксидом углерода? 30. Как может измениться рН атмосферных осадков, если в атмосферном воздухе помимо диоксида углерода появится: а) аммиак; б) диоксид серы? 31. Что такое кислотные дожди? С присутствием каких соединений в атмосферном воздухе связано их образование? 32. В чем особенность описания карбонатных равновесий для морской воды? 33. Что такое смешанные константы диссоциации угольной кислоты? 34. Какие зоны, связанные со степенью насыщения воды карбонатом кальция, выделяют в океане? 35. С чем связана особенность растворения карбонатных пород в природных водах? 36. Какие уравнения используются для описания карбонатной системы при равновесии с карбонатом кальция и воздухом, содержащим диоксид углерода? 37. Как связано содержание ионов водорода в природных водах, находящихся в равновесии с карбонатными породами и диоксидом углерода, с парциальным давлением СО2 в воздухе? 38. Как связано содержание ионов кальция в природных водах, находящихся в равновесии с карбонатными породами и диоксидом углерода, с парциальным давлением СО2 в воздухе? 39. Какое значение рН будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся вприземном слое воздуха? 40. Какую минимальную жесткость будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся в приземном слое воздуха? 41. Что такое щелочность природных вод? 42. Как экспериментально определяют щелочность природных вод? 43. Как рассчитать щелочность природных вод, зная содержание компонентов карбонатной системы и рН раствора? 44. Что такое распределительная диаграмма? Для характеристики каких параметров природных систем удобно использовать распределительные диаграммы? 45. При каких условиях и почему в процессе фотосинтеза, протекающего в природном водоеме, может увеличиться значение рН? 46. Какое значение щелочности будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся в приземном слое воздуха? 47. Что может произойти в водоеме, если его щелочность уменьшится в десять раз? 48. Какие этапы закисления природных водоемов вы знаете? 49. Что происходит с экологической системой водоема на различных этапах его закисления? 50. С чем связана особая опасность контакта закисленных природных вод с соединениями алюминия и тяжелых металлов? 51. Назовите основные особенности протекания окислительно-восстановительных процессов в природных водах. 52. В каких единицах принято измерять величину окислительно-восстановительного потенциала природных вод? 53.Какая связь существует между значениями 54. Какие окислительно-восстановительные процессы называют верх ней и нижней границами устойчивости воды? Приведите уравнение реакции. 55. Как меняется значение редокс-уровня для верхней и нижней границ устойчивости воды в зависимости от рН раствора? 56. Опишите основные принципы построения диаграмм 57. Что такое редокс-буферность природных вод? С протеканием каких процессов она связана? 58. Что такое стратификация природных водоемов? С какими причинами может быть связана стратификация водоемов? 59. Чем отличаются олиготрофные и эвтрофные водоемы в период стратификации? 60. С протеканием каких процессов связана возможность появления сероводорода в зоне гиполимниона эвтрофного водоема в период стратификации? 61. Почему периоды водообмена в эвтрофном водоеме наиболее опасны для жизни рыб? 62. Почему даже посте прекращения поступления избытка питательных веществ водоем медленно выходит из эвтрофного состояния? 63. Как меняется с глубиной содержание кислорода в воде открытого океана? 64. Как может происходить образование анаэробных зон в океанах и морях? 65. Дайте характеристику основных особенностей окислительно-восстановительных процессов в подземных водах. 66. Как принято характеризовать интенсивность водной миграции химических элементов? 67. Что такое геохимический барьер?
Задачи 1. Выразите содержание главных катионов и главных анионов для среднего состава речной воды в промилле и миллимолях на литр. 2. Представьте в виде формулы средний состав речной воды, в которой концентрация растворенного диоксида углерода составляет 1000 мг/л. 3. Сколько граммов поваренной соли (NaCl) содержится в 1 кг морской воды, отобранной в одном из заливов Северного моря, если ее хлорность равна 20%о? 4. К какому классу вод по минерализации следует отнести природные воды, состав которых соответствует среднему составу морской воды (таблица 2). При оценке принять: а) другие примеси в воде отсутствуют; б) плотность воды равна 1000 г/л; в) при экспериментальном определении минерализации все ионы гидрокарбоната перейдут в карбонат-ионы, а остальные ионы полностью переходят в безводные соли, устойчивые при 105оС. 5. Охарактеризуйте средний состав речной воды в соответствии с классификацией, разработанной О. А. Алекиным. 6. На сколько молей уменьшится равновесное содержание кислорода» в каждом литре верхнего слоя воды природного водоема при увеличении температуры приземного воздуха с 5 до 25°С, если парциальное давление кислорода не изменилось, концентрация кислорода соответствует средним для приземного слоя значениям, давление воздуха соответствует стандартным значениям? Парциальным давлением паров воды можно пренебречь. 7. Какая из двух природных вод более агрессивна по отношению к гипсу (СаSO4 . 2Н2О), если активности катионов кальция и анионов SO
Активность гипса в твердой фазе принять равной единице. 8. Какой процесс – растворение или осаждение гипса – будет происходить при его контакте с природной водой, в которой активности катионов кальция и анионов SO 9. Какой из минералов, не содержащих примесей, – гипс (CaSO4 . 2Н2О) или ангидрит (CaSO4) – более устойчив в водном растворе при нормальном атмосферном давлении и температуре 60° С? 10.Сколько миллиграммов ионов фтора может содержаться при нормальных условиях в природной воде, находящейся в равновесии с флюоритом (СаF2), не содержащим примесей, если в воде содержится хлорид натрия в концентрации 0,03 М? Сравните полученные значения с предельно допустимой концентрацией ионов фтора в водоемах рыбохозяйственного назначения, которая составляет ПДКР.Х = 0,75 мг/л. 11. Определите значение общей и карбонатной жесткости для среднего состава атмосферных осадков (таблица 2). Ответ дайте в молях на литр, немецких, французских и американских градусах жесткости. К какой группе вод по величине жесткости следует отнести эти воды? Принять плотность воды равной 1 кг/л. 12. Какое значение рН наблюдалось в дождевой воде, находящейся в равновесии с атмосферным воздухом, содержащим в качестве примесей («активных компонентов») лишь диоксид углерода, в эпоху оледенения, если его содержание в приземном воздухе составляло 200 млн –1? На сколько единиц изменился рН к настоящему времени при содержании СО2 в атмосферном воздухе 0,035%(об.)? Принять температуру воздуха равной 298 К, давление равным 101,3 кПа, парциальное давление паров воды равным 0,031 атм. 13. Какое значение рН следует ожидать у дождевой воды, находящейся в равновесии с атмосферным воздухом, содержащим 0,035% (об.) диоксида углерода, 1,5 млрд–1 диоксида серы и 1,2 млрд–1 аммиака? Температура воздуха равна 298 К, давление 101,3 кПа; парциальное давление паров воды принять равным 3,16 кПа. Какой вклад (в %) вносят эти примеси в процесс закисления дождевой воды? 14. Постройте зависимость доли соответствующего компонента от рН раствора (распределительную диаграмму) для системы SO2 – H2O. Какие ионы или молекулы, характерные для этой системы, будут находиться в растворе, если его рН соответствует: а) значению рН идеального дождя? б) значению рН закисленного водоема (3-я стадия закисления)? 15. Проба природной воды имеет щелочность, равную 1,5 ммоль/л, значение рН этой воды равно 7, температура 298 К. Оцените концентрацию компонентов карбонатной системы в данной пробе. Каким будет парциальное давление диоксида углерода в воздухе, находящемся в равновесии с этой водой? Какие значения концентраций компонентов карбонатной системы будут наблюдаться в этой воде, если контакт с воздухом будет нарушен (поступления СО2 не будет), а в результате протекания фотосинтеза рН станет равным 10,5? Процессы растворения или осаждения карбонатов в системе не происходили. Принять коэффициенты активности компонентов карбонатной системы равными единице. 16. Какое количество мг/л органического вещества условной формулы СН2О могло образоваться в водоеме в процессе фотосинтеза, если был нарушен контакт с воздухом и карбонатными породами, растворения или выделения диоксида углерода и карбоната кальция не происходило? Щелочность воды в исходном растворе составляла Щ = 1,5ммоль/л, рН = 7. В процессе фотосинтеза рН увеличился до значения 10,5. Процесс протекал при нормальном давлении и температуре 298К. 17. Как изменится рН в водоеме в результате процесса фотосинтеза, если поступление СО2 отсутствует? Температура водоема 25°С, щелочность воды 1,5 ммоль/л, начальное значение рН = 7,8. В процессе фотосинтеза в каждом литре воды образовалось 25 мг органических соединений условной формулы СН2О. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ,(100)
,(100) – рН для системы Fe – О – Н2О, принимая во внимание лишь следующие превращения: Fe2O3 – Fe3O4; Fe3+–Fe2O3; Fe3+– Fe2+; Fe2O3 – Fe2+; опишите области устойчивого существования соединений железа при различных значениях рН.
– рН для системы Fe – О – Н2О, принимая во внимание лишь следующие превращения: Fe2O3 – Fe3O4; Fe3+–Fe2O3; Fe3+– Fe2+; Fe2O3 – Fe2+; опишите области устойчивого существования соединений железа при различных значениях рН. 3Fe2O3 + 2
3Fe2O3 + 2  +2Н+ 2Fe3O4 + Н2О.
+2Н+ 2Fe3O4 + Н2О. )2(aH+)2]
)2(aH+)2] 1gtK – pH.
1gtK – pH. –30,88 (кДж/моль); ДС°
–30,88 (кДж/моль); ДС°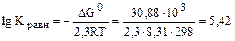
 Fe2O3 + 6Н+ 2Fe3+ + 3Н2О.
Fe2O3 + 6Н+ 2Fe3+ + 3Н2О.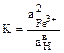
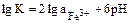
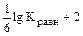
 Fe3+ +
Fe3+ + 
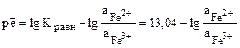
 обычно в таких случаях принимается равным 1, но нужно иметьввиду, что выше этой границымогут наблюдаться отличные от нуля концентрации Fe2+, а ниже ее – отличные от нуля концентрации Fe3+.
обычно в таких случаях принимается равным 1, но нужно иметьввиду, что выше этой границымогут наблюдаться отличные от нуля концентрации Fe2+, а ниже ее – отличные от нуля концентрации Fe3+. Fe2O3 + 2
Fe2O3 + 2 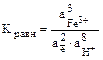
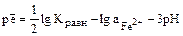
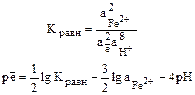




 O2 + H+ +
O2 + H+ +  Н2О;
Н2О; Fe3O4 + 2
Fe3O4 + 2 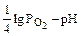
 = (Робщ – j
= (Робщ – j  )С
)С 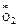
 lg(0,20) – 7 = 13,6.
lg(0,20) – 7 = 13,6.
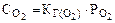
 = 2,63 . 10–4 .
= 2,63 . 10–4 .  = 2,63 . 10–4 . 32 = 8,4 . 10-3 (г/л) = 8,4 (мг/л).
= 2,63 . 10–4 . 32 = 8,4 . 10-3 (г/л) = 8,4 (мг/л). ,
, – количество кислорода в мг, содержащееся в каждом литре воды;
– количество кислорода в мг, содержащееся в каждом литре воды; ,
, – молярные массы кислорода и сахара соответственно;
– молярные массы кислорода и сахара соответственно;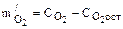
 – количество кислорода, которое может быть израсходовано на окисление сахара из каждого литра природной воды;
– количество кислорода, которое может быть израсходовано на окисление сахара из каждого литра природной воды; – минимальное содержание кислорода в воде после окисления сахара;
– минимальное содержание кислорода в воде после окисления сахара; = 11,23 . 103/4,4 = 2500 (л).
= 11,23 . 103/4,4 = 2500 (л). + 2Н2О ® H2S + 2HCO
+ 2Н2О ® H2S + 2HCO 
 = 10–2,5моль/л;
= 10–2,5моль/л;  = 10–2,7моль/л;
= 10–2,7моль/л; =10–1,7моль/л;
=10–1,7моль/л;  =10–2,3моль/л.
=10–2,3моль/л.