|
|
И кислотно-основными характеристиками природных вод
Перенос электрона в редокс-процессе сопровождается переносом протона, обусловливая тем самым для реакций, протекающих в водном растворе, жесткую взаимосвязь между окислительно-восстановитель-ным и кислотно-основным равновесием. Например, если ион Fe(II) отдает электрон, то выделяются три иона водорода, что приводит в конечном результате к образованию труднорастворимого гидроксида железа (III) и увеличению концентрации ионов водорода в растворе:
Протеканием этой реакции объясняется кислый характер шахтных вод и образование характерного осадка «ржавчины» в местах выхода на поверхность подземных вод, содержащих ионы двухвалентного железа. Величина окислительно-восстановительного потенциала реакций, протекающих с участием ионов водорода или гидроксила, зависит от рН раствора. Одной из форм представления таких зависимостей являются диаграммы Рассмотрим принципы построения диаграммы Вода может окисляться 2Н2О ® О2 + 4Н+ + 4 либо восстанавливаться: 2Н2О + 2 Реакции (79) и (80) определяют пределы изменения Перепишем уравнение (79) в виде:
Константу равновесия этой реакции можно представитьуравнением:
В качестве граничных условий при описании пределов устойчивости воды обычно принимают давление кислорода 101 кПа (1 атм), при этом Р(кисл) = 1. Активность воды также можно принять равной единице. В этом случае уравнение (82) можно представить в виде:
Прологарифмировав уравнение (2.83), умножим его левую и правую части на минус единицу; заменив выражения отрицательных логарифмов активности электронов и ионов водорода на
Величину логарифма константы равновесия этой реакции легко найти из значения энергии Гиббса образования молекул воды, поскольку DGобразования кислорода, ионов водорода и электронов по термодинамическим конвенциям принимаются равными нулю, поэтому lg К = Отсюда зависимость
В общем случае получим:
Уравнение (87) определяет окислительную границу устойчивости воды. При заданном значении рН для воды, находящейся в равновесии с атмосферным кислородом, ( Путем аналогичных рассуждений можно получить зависимость
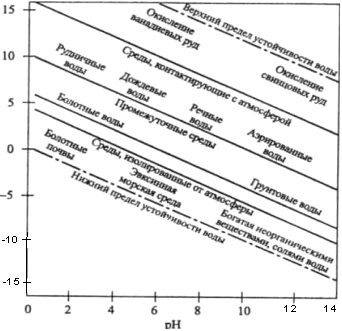
Рис. 4.Зависимость окислительно-восстановительного потенциала (для различных природных вод) и пределов устойчивости воды от рН
Поскольку DGреакции (88) равно нулю, то и значение логарифма константы равновесия этой реакции равно нулю. Поэтому при граничных условиях, когда парциальное давление водорода равно 1 атм, получаем уравнение:
Природные воды обычно находятся в контакте с воздухом, в котором парциальные давления кислорода и водорода меньше 1 атм, поэтому их окислительно-восстановительные потенциалы будут находиться в интервале значений, определяемых уравнениями (86) и (91). На рисунке 4 представлены зависимости величины Диаграммы Как уже отмечалось выше, в реальных природных водах окислительно-восстановительные процессы протекают при участии бактерий. В каждой из окислительно-восстановительных реакций участвует свой тип бактерий, и реакции протекают в строгой последовательности. Раньше протекают реакции, обеспечивающие бактериям наибольшую энергию, т. е. те реакции, для которых в данных условиях окислительно-восстановительный потенциал имеет наибольшее значение. Поэтому при построении обобщающих

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 [Fe(H2O)6]2+ Fe(OH)3 ¯ + 3Н2О + 3Н+ +
[Fe(H2O)6]2+ Fe(OH)3 ¯ + 3Н2О + 3Н+ +  (78)
(78) – рН или диаграммы Eh– рН. Диаграммы эти идентичны, за исключением шкалы оси ординат, масштаб которой изменяется в соответствии с уравнением (75). При температуре 298 К Eh= 0,0591
– рН или диаграммы Eh– рН. Диаграммы эти идентичны, за исключением шкалы оси ординат, масштаб которой изменяется в соответствии с уравнением (75). При температуре 298 К Eh= 0,0591  O2 + H+ +
O2 + H+ +  Н2О (81)
Н2О (81) (82)
(82) = 1/(Кан+) (83)
= 1/(Кан+) (83)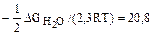 (85)
(85) – pH. (87)
– pH. (87) (88)
(88)
 ; (89)
; (89) (90)
(90)