
|
|
Процессы закисления поверхностных водоемов
Выпадение атмосферных осадков с повышенным содержанием ионов водорода по отношению к равновесному может привести к серьезным изменениям в состоянии поверхностных водных систем озера и пруда. Можно условно выделить три стадии процесса их закисления. В нормальном водоеме, несмотря на поступление кислых осадков, рН практически не меняется. Гидрокарбонат-ионы, присутствующие в поверхностных водоемах, успевают полностью нейтрализовать поступающие ионы Н+:
Так продолжается до тех мор, пока общая щелочность воды в водоеме не упадет примерно в 10 раз, до величины менее 0,1 ммоль/л. Это может произойти, например, при нарушении контакта данной воды с карбонатными породами. Такой водоем находится на первой стадии закисления. В этом случае в период наиболее интенсивного поступления кислых вод в водоем (осень – обильные дожди – и особенно весна – таяние снега) возможны значительные отклонения в величине рН поверхностных водоемов. Эти отклонения не носят ярко выраженного характера, и с прекращением интенсивного поступления кислых осадков водоем переходит в обычное состояние: рН поднимается до первоначальных значений. Необходимо отметить, однако, что даже эти кратковременные изменения чрезвычайно опасны для водных экосистем, поскольку их сроки совпадают с периодами размножения отдельных видов водных организмов. В этом случае изменение рН может привести к нарушению репродуктивных функций отдельных организмов или нарушить процесс воспроизводства для определенных популяций. На первом этапе закисления, например, могут погибнуть все земноводные организмы, икра и молодь, которые особенно чувствительны к изменениям рН. На второй стадии закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года (отсутствует контакт с карбонатными породами); о таких водоемах обычно говорят как об умеренно кислых. На этой стадии закисления происходят значительные изменения в видовом составе живых организмов (рисунок 3). На третьей стадии закисления рН водоемов стабилизируется на значениях рН < 5 (обычно рН 4,5), даже если атмосферные осадки имеют более высокие значения рН. Это связано с присутствием гумусовых веществ и соединений алюминия в водоемах и почвенном слое. Гумусовые соединения в основном представлены в водоемах растворами слабых органических кислот, имеющими рН < 5. Связывая или выделяя ионы Н+, эти кислоты стабилизируют значение рН в водоеме. Этому способствуют и соединения алюминия, практически всегда присутствующие в почве. При растворении или осаждении соединений алюминия также происходит связывание или выделение ионов водорода. Как известно, ионы алюминия обладают высокой токсичностью по отношению ко многим видам водных живых организмов и человеку. Поэтому их поведение в процессах закисления необходимо рассмотреть более подробно.
Рис. 3. Влияние рН водоема на степень развития популяций водных организмов
Одним из распространенных соединений алюминия является гиббсит – А1(ОН)3. При растворении гиббсита в растворе могут присутствовать различные ионы, из которых наиболее важными являются Al3+, Al(OH)
Константа равновесия этого процесса имеет вид:
При рН 5,6 в растворе преобладают ионы А1(ОН)
Константа равновесия в этом случае имеет вид:
При более высоких значениях рН (рН > 7) в растворе преобладают ионы А1(ОН)
Константу равновесия этого процесса можно рассчитать по уравнению:
Суммарная активность форм растворенного алюминия (aAl)cyм равна сумме активностей основных ионов:
Выражая активность ионов через значения соответствующих констант и активность ионов водорода, получим:
Помимо рассмотренных выше ионов в растворах, равновесных с гиббситом, существует также ион А1(ОН)2+, но его концентрация не достигает значений, которые могли бы оказать заметное влияние на растворение А1(ОН)3–. В разбавленных растворах, которые обычно представляют собой пресноводные поверхностные водоемы, с определенной степенью приближения можно принять коэффициенты активности ионов Аl3+равными единице. Проведенные при этом допущении расчеты показывают, что при рН 6 концентрация ионов А13+ в растворе будет составлять всего 1.4 . 10–4 мг/л.С увеличением кислотности до значений рН 5 концентрация А13+ возрастет в 1000 раз и составит 0,14 мг/л, а при уменьшении рН до 4 в растворе будет присутствовать уже около 140 мг/л ионов А13+. Изменение видового состава водных экологических систем (рисунок 3) при закислении водоемов во многом связано именно с увеличением содержания ионов А13+ в растворе, которые, переходя в нерастворимые соединения в организме рыб (наиболее часто в жабрах), являются причиной их гибели. Следует отметить, что при уменьшении рН воды природного водоема (особенно при переходе в третью стадию закисления) резко возрастает содержание в воде и других примесей, в частности ионов тяжелых металлов, что, как и в случае с алюминием,может ускорить процесс гибели экосистемы.
Примеры решения задач
Пример 12.Какое значение рН следует ожидать в дождевой воде, находящейся в равновесии с атмосферным воздухом, содержащим в качестве примесей («активных компонентов») лишь диоксид углерода в количестве 0,035%(об.)? На сколько единиц рН оно может измениться при прогнозируемом увеличении содержания СО3 в атмосферном воздухе в два раза? Принять температуру воздуха равной 298 К, давление – 101,3 кПа,парциальное давление паров воды – 3,12 . 10–3 атм. Решение. Процесс растворения диоксида углерода в воде, приводящий к появлению в растворе ионов водорода и, следовательно, изменению рН воды, может быть представлен следующим брутто-уравнением:
Проведенный в разделе 5.1 анализ возникающих в этом процессе равновесий позволил вывести уравнение, связывающее рН образующегося раствора и парциальное давление диоксида углерода (уравнение 31): pH = –lg[H+]= –lg (K1KГ(co2)Pco2)1/2. Необходимые для расчета рН значения константы диссоциации угольной кислоты по первой ступени и константы Генри для диоксида углерода, которые зависят от температуры процесса, можно найти в справочной литературе. Для условий задачи они приведены в таблице 3 Приложения: K1= 4,45 . 10–7 моль/л; Кг(СО2) = 3,3 . 10–2 моль/(л . атм). Парциальное давление диоксида углерода можно рассчитать, зная его концентрацию в воздухе, общее давление и давление паров воды в системе. В настоящее время парциальное давление диоксида углерода составляет: Рсо2 = (Робщ – Рн2о) . Ссо2[%(об.)]/100 = (1 – 3,12 . 10–3) . 0,035/100 = = 3,5 . 10–4 (атм). При увеличении содержания диоксида углерода в воздухе в два раза его парциальное давление удвоится и составит:
В настоящее время рН атмосферных осадков при присутствии в воздухе только диоксида углерода составляет: рН = –lg (4,45 . 10–7 . 3,3 . 10–2 . 3,5 . 10–4)1/2 = 5,6. При удвоении содержания диоксида углерода в воздухе рН атмосферных осадков составит:
рН/ = –lg (4,45 . 10–7 . 3,3 . 10–2 . 7,0 . 10–4)1/2 = 5,5. Изменение рН составит: DрН= рН – рН/ = 5,6 – 5,5 = 0,1. Ответ: в настоящее время рН атмосферных осадков при присутствии в воздухе в качестве примеси только диоксида углерода должен составлять рН 5,6. При удвоении содержания диоксида углерода рН дождевой воды изменится на 0,1 единиц рН и составит рН/ 5,5. Пример 13. Какое значение рН следует ожидать у дождевой воды, находящейся в равновесии с атмосферным воздухом, содержащим 0,035%(об.) диоксида углерода, 1 млрд–1 диоксида серы и 1 млрд–1 аммиака? Температура воздуха равна 298 К, давление – 101,3 кПа, парциальное давление паров воды принять равным 3,16 кПа. Какой вклад (%) вносят эти примеси в процесс закисления дождевой воды? Решение. Процессы растворения в дождевой воде диоксида углерода, диоксида серы и аммиака можно представить следующими брутто-уравнениями:
Для этих процессов, как было отмечено выше (раздел 5.1), можно рассчитать концентрацию образующихся ионов водорода (гидроксила – для случая растворения аммиака) по уравнению (30): [Н+] = (K1i . Kгi . Pi)1/2 или – при растворении аммиака – [ОН–] = (KNH4OH . Kг(NH3) . PNH3)1/2 где K1iи KNH4OH – константы диссоциации угольной или сернистой кислот по первой ступени и гидроксида аммония соответственно; Kгi и Kг(NH3) – константы Генри для диоксида углерода или диоксида серы и аммиака соответственно; Piи PNH3– парциальные давления диоксида углерода или диоксида серы и аммиака соответственно. Значения констант диссоциации кислот и гидроксида аммония, а также значения соответствующих констант Генри приводятся в справочной литературе; при 298 К значения этих величин, как следует из таблицы 3 Приложения, равны: K1(Н2СО3) = 4,45 . 10–7 моль/л; K1(H2SO4) = 2,7 . 10–2 моль/л; KNH4OH = 1,6 . 10–5 моль/л; КГ(СО2) = 3,3 . 10–2 моль/(л . атм); КГ(SO2) = 5,34 моль/(л . атм); КГ(NН3) = 89,1 моль/(л . атм). Парциальное давление соответствующих примесей можно рассчитать, зная их концентрацию, общее давление и давление паров воды в воздухе (Пример 12). Однако следует учесть, что: - концентрации диоксида серы и аммиака в воздухе выражены в млрд–1, поэтому для перевода их в объемные доли необходимо умножить соответствующее значение концентрации на 10–9 ; - концентрация диоксида углерода выражена в %(об.); для перевода в объемные доли необходимо ее значение умножить на 10–2; - общее давление смеси, давление паров воды и значения соответствующих констант Генри, которые будут использованы в дальнейших расчетах, приведены в различных единицах измерения давления; для выражения их в одних и тех же единицах в данном случае достаточно разделить значение давления, выраженное в кПа, на 101,3. Парциальное давление соответствующих примесей в воздухе составит: Pi = (Робщ – РН2О)ai; PCO2= (101,3 – 3,16) . 0,035 . 10–2/101,3 = 33,9 . 10–5 (атм); PSO2= (101,3 – 3,16) . 1 . 10–9/101,3 = 9,69 . 10–10 (атм); PNH3= (101,3 – 3,16) . 1 . 10–9/101,3 = 9,69 . 10–10(атм). Концентрации ионов водорода, образующихся при растворении диоксида углерода и диоксида серы, составят: [Н+]Н2СО3= (4,45 . 10–7 . 3,3 . 10–2 . 33,9 . 10–5)1/2 = 2,23 . 10–6 (моль/л); [H+]H2SO3= (2,7 . 10–2 . 5,34 . 9.69 . 10–10)1/2 = 1,18 . 10–5 (моль/л). Концентрация ионов гидроксила, образующихся при растворении аммиака, составит: [OH–]NH4OH = (1,6 . 10–5 . 89,1 . 9,69 . 10–10)1/2 = 1,17.10–6 (моль/л). Ионы гидроксила, образующиеся при растворении аммиака, могут связывать ионы водорода с образованием молекул воды:
Поэтому для определения общего содержания ионов водорода в растворе следует сложить концентрации ионов Н+, образующиеся при растворении диоксида углерода и диоксида серы, и вычесть концентрацию ионов гидроксила, образующихся при растворении аммиака. Общее содержание ионов водорода в растворе составит: [H+]общ = [H+]H2CO3+ [H+]H2SO3– [OH–]NH4OH; [H+]общ = 2,23 . 10–6 + 1,18 . 10–5 – 1,17 . 10–6 = 1,29 . 10–5 Значение рН этого раствора составит: рН = –lg[H+] общ = 4,9. Вклад каждой из примесей в процесс закисления природной воды можно определить по их процентной доле в общей концентрации ионов водорода, взятой с соответствующим знаком: ai = ±[H+]i . 100/[H+]общ(%) aCO2 = 2,23 . 10–6 . 100/(1,29 . 10–5) = +17% aSO2 =1,18 . 10–5 . 100/(1,29 . 10–5) = +91% aNH3 = –[1,17 . 10–6 . 100/(1,29 . 10–5)] = –9,1% Ответ: раствор будет иметь значение рН 4,89; вклад примесей в процесс закислениясоставит: диоксида углерода – +17%, диоксида серы – +91%, аммиака – –9,1%. Пример 14. Выведите выражение для расчета и оцените значение доли каждого из компонентов карбонатной смеси (СО2(р.р); НСО [Н+] » К1(Н2СО3); [Н+] = К1(Н2СО3); [Н+] = (К1(Н2СО3) К2(Н2СО3))1/2; [Н+] = К2(Н2СО3); [Н+] « К1(Н2СО3). При оценке принять, что коэффициенты активности всех компонентов в системе равны единице, температура равна 298 К. Решение. Долей соответствующего компонента в карбонатной системе является отношение концентрации компонента к суммарной концентрации компонентов данной системы в растворе:
Для получения уравнений, связывающих долю соответствующего компонента карбонатной системы и величину рН раствора, воспользуемся уравнениями диссоциации угольной кислоты по первой и второй ступеням (уравнения 24, 26, 29). Поскольку по условию задачи коэффициенты активности всех компонентов равны единице, выражения для констант диссоциации угольной кислоты можно представить в виде: К1= [Н+][НСО K2= [Н+][СО32–]/[НСО3–]. (1.2) Выразим концентрацию диоксида углерода в растворе из уравнения (1.1): [СО2(р-р)] = [Н+][НСО3–]/К1 (1.3) а концентрацию гидрокарбонат-ионов — из уравнения (1.2): [НСО3–] = [Н+][СО32–]/K2. (1.4) Подставив выражение для определения концентрации гидрокарбонат-ионов в уравнение (1.3), получим: [CO2(р.р)] = [H+][H+][CO32–]/(K1,K2) = [Н+]2[СО32–]/(K1,K2). (1.5) Воспользуемся уравнениями (3)-(5) для выражения суммы концентраций всех компонентов системы: [СО2(р-р)] + [НСО3–] + [СО32–] Преобразован это уравнение, легко получить: [СО2(р.р)] + [НСО3–] + [СО32–] = [СО32–] Подставляя уравнения (1.4)-(1.6) в выражения, определяющие доли соответствующих компонентов в системе, получим зависимости, связывающие доли компонентов со значениями констант диссоциации и концентрацией ионов водорода в растворе:
Уравнения (1.7), (1.8) позволяют, подставляя соответствующие значения, вычислить или, оперируя действиями с бесконечно малыми и бесконечно большими числами и принимая во внимание, что константа диссоциации угольной кислоты по первой ступени значительно больше константы диссоциации по второй ступени (К1 = 4,45 . 10–7 моль/л и К2 = 4,69 . 10–11 моль/л, таблица 7 Приложения), без вычислений оценить значения долей компонентов при рН, соответствующих «ключевым» точкам распределительной диаграммы. Полученные значения долей компонентов карбонатной системы представлены в таблице 1.1: Таблица 1.1. Значения долей компонентов карбонатной системы
Ответ:таблица 1.1. Пример 15.Проба природной воды имеет щелочность, равную 1,1 ммоль/л; значение рН этой воды равно 6; температура 298 К. Оцените концентрации компонентов карбонатной системы в данной пробе. Каким будет парциальное давление диоксида углерода в воздухе, находящемся в равновесии с этой водой? Какими будут концентрации компонентов карбонатной системы в этой воде, если контакт с воздухом будет нарушен (прекратится поступление СО2), а в результате протекания фотосинтеза рН станет равным 10? Процессов растворения или осаждения карбонатов в системе не происходило. Принять коэффициенты активности компонентов карбонатной системы равными единице. Решение. По условию задачи предлагается оценить концентрацию компонентов карбонатной системы ([СО2(Р-Р)], [НСО Рассмотрим первый случай: рН 6. Концентрация ионов водорода в этом растворе равна 10–6 моль/л. В соответствии с распределительной диаграммой в этом случае в растворе практически отсутствуют [СО [ОН–] = 10–14/10–6 = 10–8 моль/л, поэтому щелочность раствора практически полностью связана с присутствием в растворе гидрокарбонат-ионов: Щ = [НСО Помимо ионов [HCO K1 = [H+][HCO [CO2(p-p)] = [H+][HCO [CO2(P.P)] = 10–6 . 1,1 . 10–3/(4,45 . 10–7) = 2,4 . 10–3 (моль/л). Парциальное давление диоксида углерода в воздухе, находящемся в равновесии с этим раствором, можно найти, используя закон Генри (уравнение 1): [CO2(p-p)]=KГ(СO2)PCO2 PCO2=[CO2(p-p)] KГ(СO2) Значение константы Генри для диоксида углерода при 298 К равно (таблица 3 Приложения): KГ(СO2) = 3,3 . 10–2 моль/(л . атм). В рассматриваемом случае имеем: PCO2= 2,4 . 10–3 . 3,3 . 10–2 = 7,9 . 10–5 (атм) = 8,0 (Па). Рассмотрим случай, когда в результате фотосинтеза рН раствора увеличился до 10. Концентрация ионов водорода в этом растворе равна 10–4 моль/л. В этом случае в растворе практически отсутствует растворенный диоксид углерода (распределительная диаграмма на рисунке 2), карбонатная система представлена ионами [НСО Первое уравнение можно получить из выражения щелочности раствора. В данном случае при определении щелочности следует учитывать все ее составляющие. Поскольку в системе отсутствовали процессы растворения или осаждения, величина щелочности системы не изменилась, и можно записать равенство: Щ = [HCO Концентрация ионов гидроксила равна: [ОН–] = 10–14/10–10 = 1 . 10–4 (моль/л). Подставив это значение в выражение щелочности, получим: [HCO В качестве второго уравнения, связывающего концентрации гидрокарбонат- и карбонат-ионов в растворе, можно взять выражение для константы диссоциации угольной кислоты по второй ступени: К2= [Н+][НСО В нашем случае, поскольку [Н+] = 10–10 моль/л, получим равенство: [НСО Отсюда [НСО Подставив это равенство в полученное выражение щелочностии выполнив необходимые преобразования и вычисления, получим значение концентрации карбонат-ионов: [HCO [СO Концентрация гидрокарбонат-ионов составит: [НСО Ответ: при рН 6 концентрации компонентов карбонатной системы составят: [СО2(р-р)] = 2,4 . 10–3 моль/л, [НСО Пример 16. Какое количество мг/л органических соединений условной формулы (СН2О) могло образоваться в водоеме в процессе фотосинтеза, если был нарушен контакт с воздухом и карбонатными породами, растворения или выделения диоксида углерода и карбоната кальция не происходило? В исходном растворе рН 6 щелочность воды составляла Щ = 1,1 ммоль/л. В процессе фотосинтеза рН увеличился до значения рН 10. Процесс протекал при нормальном давлении и температуре 298 К. Решение.Процесс фотосинтеза, протекающего в водоеме при отсутствии растворения диоксида углерода, может быть представлен упрощенным брутто-уравнением вида: НСО Анализ этого уравнения показывает, что в процессе фотосинтеза при отсутствии растворения и осаждения происходит изменение в соотношении компонентов карбонатной системы, но щелочность раствора не меняется, поскольку на каждый прореагировавший ион гидрокарбоната образуется один ион гидроксила. В начальный момент (при рН 6) все атомы углерода входят в состав неорганических соединений – компонентов карбонатной системы. В растворе, образовавшемся после протекания процесса фотосинтеза, атомы углерода уже входят в состав не только компонентов карбонатной системы, но и в состав органических соединений. Следует обратить внимание и на тот факт, что общее содержание атомов углерода в системе остается неизменным, поэтому можно написать равенство:
где S[С(орг)] – концентрация атомов углерода (моль/л), связанных в процессе фотосинтеза в органические соединения. Отсюда количество атомов углерода, входящих в состав органических соединений, составит:
Зная общее количество атомов углерода, связанных в каждом литре воды в органическое соединение, и зная молекулярную формулу синтезируемого органического соединения, легко найти его массу:
где m(орг.соед) – количество органического соединения, синтезируемого в каждом литре воды, мг/л;
М – молярная масса органического соединения, г/моль; 103 – коэффициент перевода массы из г в мг. Таким образом, для решения задачи необходимо найти суммарную концентрацию компонентов карбонатной системы при рН 6 и при рН 10. Как было показано в Примере 15, при рН 6 в карбонатной системе присутствуют лишь ионы HCO [НСО [СО2(р-р)] = 2,4 . 10–3 моль/л. При рН 10 карбонатная система представлена лишь гидрокарбонат- и карбонат-ионами, а их концентрации при щелочности раствора, равной 1,1 ммоль/л, равны (Пример 15): [HCO [СО Поскольку в каждом из компонентов карбонатной системы содержится лишь один атом углерода, суммарная концентрация атомов углерода, связанных с компонентами карбонатной системы, будет равна сумме концентраций компонентов, выраженных в моль/л:
Поэтому для исходного раствора, имеющего щелочность 1,1 ммоль/л, суммарные концентрации атомов углерода в составе всех компонентов карбонатных систем, образующихся в растворе при рН 6 и рН 10, составят:
= 3,5 . 10-3 (моль/л),
= 5,95 . 10–4 (моль/л). Отсюда концентрация атомов углерода, связанных в органические соединения, составит:
= 2,90 . 10–3 (моль/л). Поскольку по условию задачи в воде синтезировались лишь органические соединения общей формулой СН2О, молярная масса которых составляет М = 12 + 1 . 2 + 16 = 30 (г/моль), количество органических соединений, синтезированных в каждом литре воды, составит: m(орг.соед) = Ответ: в водоеме могло образоваться 87 мг/л органических соединений общей формулы СН2О. Пример 17.Какое значение рН будут иметь поверхностные воды, находящиеся в равновесии с атмосферным воздухом, в котором среди «активных» примесей присутствует лишь диоксид углерода, и карбонатными породами, состоящими из кальцита (СаСО3)? Концентрация диоксида углерода в воздухе составляет 0,035%(об.), температура равна 298 К; общее давление воздуха – 101,3 кПа, парциальное давление паров воды – 3160 Па. При оценке принять, что коэффициенты активности всех компонентов равны единице. Решение.Поскольку в данном случае поверхностные воды можно представить как раствор карбоната кальция, находящийся в контакте с воздухом, содержащим диоксид углерода, равновесие описывается следующим равенством (уравнение 33):
Как отмечалось выше, для этого равновесного состояния зависимость концентрации ионов водорода в растворе от парциального давления диоксида углерода в воздухе может быть представлена уравнением (38), которое при условии равенства коэффициентов активности всех компонентов раствора единице может быть записано в виде:
где [Н+] – концентрация ионов водорода, моль/л; РСО2– парциальное давление диоксида углерода в воздухе, Па; К1и К2 — константы диссоциации угольной кислоты по первой и второй ступеням соответственно; Кг(СО2) – константа Генри для диоксида углерода; KСаСО3– константа равновесия процесса растворения кальцита при отсутствии контакта раствора с диоксидом углерода. Парциальное давление диоксида углерода легко найти по общему давлению в системе и концентрации диоксида углерода в воздухе: РСО2= (Робш – РН2О) . ССО2[%(об.)]/100 = = (101,3 – 3,16) . 0,035/100 = 3,43 . 10–2 (кПа) = 3,39 . 10–4(атм). Значения констант диссоциации угольной кислоты по первой и второй ступеням и константы Генри приводятся в справочной литературе; для условий задачи эти константы составляют (таблица 3 Приложения): К1 =4,45 . 10–7 моль/л; К2 = 4,69 . 10–11 моль/л; Kг(СО2) = 3,3 . 10–2 моль/(л . атм). Процесс растворения кальцита при отсутствии контакта раствора с диоксидом углерода можно представить следующим уравнением:
Константа равновесия этого процесса может быть представлена уравнением:
Численное значение этой константы можно определить из значения энергии Гиббса процесса растворения кальцита:
Значение
Численные значения энергии Гиббса для этих ионов и кальцита при стандартных условиях приведены в Приложении. Подставив необходимые значения в выражение для энергии Гиббса процесса растворения кальцита, получим:
= 48,1 . 103 (Дж/моль). Значение логарифма константы равновесия составит:
Значение константы равновесия составит:
Подставив найденные в справочной литературе и рассчитанные для условий задачи значения соответствующих констант и парциального давления диоксида углерода в уравнение зависимости концентрации ионов водорода в растворе от парциального давления СО2, получим:
Такая концентрация ионов водорода соответствует рН, равному: рН = –lg[H+] = 8,3. Ответ: поверхностные воды будут иметь рН 8,3. Пример 18. Какие жесткость и щелочность будут иметь поверхностные воды, находящиеся в равновесии с атмосферным воздухом, в котором среди «активных» примесей присутствует лишь диоксид углерода, и карбонатными породами, состоящими из кальцита (СаСО3)? Концентрация диоксида углерода в воздухе составляет 0,035%(об.), температура равна 298 К; общее давление воздуха – 101,3 кПа, парциальное давление паров воды – 3160 Па. При оценке принять, что коэффициенты активности всех компонентов равны единице. Решение. Процесс растворения карбоната кальция в присутствии диоксида углерода протекает в основном по уравнению (33):

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 НСО
НСО 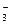 + Н+ Н2О + СО2. (56)
+ Н+ Н2О + СО2. (56)
 и А1(ОН)
и А1(ОН)  . Каждый из них преобладает в определенных интервалах рН, поэтому растворимость гиббсита зависит от рН. При низких значениях рН (рН < 4,5) в растворах преобладают ионы А13+, и процесс растворения можно представить уравнением:
. Каждый из них преобладает в определенных интервалах рН, поэтому растворимость гиббсита зависит от рН. При низких значениях рН (рН < 4,5) в растворах преобладают ионы А13+, и процесс растворения можно представить уравнением: А1(ОН)3 + 3Н+ А13+ + 3Н2О (57)
А1(ОН)3 + 3Н+ А13+ + 3Н2О (57) (58)
(58) А1(ОН)3 + Н+ А1(ОН)
А1(ОН)3 + Н+ А1(ОН) 

 А1(ОН)3 + Н2О А1(ОН)
А1(ОН)3 + Н2О А1(ОН)  (62)
(62) (63)
(63) (64)
(64) СO2(г)+H2O H++HCO
СO2(г)+H2O H++HCO 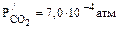
 .
. Н+ +ОН– Н2О
Н+ +ОН– Н2О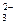 ) в следующих «ключевых» точках распределительной диаграммы:
) в следующих «ключевых» точках распределительной диаграммы: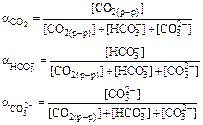
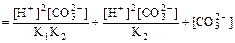
 (1.6)
(1.6) (1.7)
(1.7) (1.8)
(1.8) (1.9)
(1.9)


 {CH2O} + O2 + OH–.
{CH2O} + O2 + OH–. ,
, и
и  – суммарная концентрация атомов углерода в составе всех компо-нентов карбонатных систем (моль/л), образующихся в растворе при рН 6 и рН 10 соответственно;
– суммарная концентрация атомов углерода в составе всех компо-нентов карбонатных систем (моль/л), образующихся в растворе при рН 6 и рН 10 соответственно;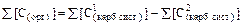
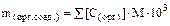
 – концентрация атомов углерода связанных в процессе фотосинтеза в органическое соединение, моль/л;
– концентрация атомов углерода связанных в процессе фотосинтеза в органическое соединение, моль/л; =[СО2(р-р)] + [НСО
=[СО2(р-р)] + [НСО  = [НСО
= [НСО  = [НСО
= [НСО  =
= 
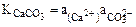
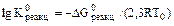
 можно определить из выражения:
можно определить из выражения: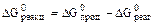
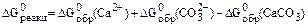
 = –48,1 . 103/(2,3 . 8,34 . 298) = –8,41.
= –48,1 . 103/(2,3 . 8,34 . 298) = –8,41. = КСaСО3= 3,9 . 10–9
= КСaСО3= 3,9 . 10–9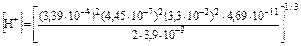 = 5,3 . 10–9 (моль/л).
= 5,3 . 10–9 (моль/л).