
|
|
Аномальные свойства воды и состав природных водФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ В ГИДРОСФЕРЕ Учебное пособие
САРАТОВ - 2006
ББК 20.1 я 73
Т.Г. Дмитриенко
Учебное пособие «Физико-химические процессы в гидросфере» предназначено для студентов-экологов, изучающих курс «Химия окружающей среды» и должно способствовать научить будущих специалистов решать задачи, связанные с физико-химическими процессами, происходящими в гидросфере. В пособии рассмотрены способы классификации природных вод, основные процессы формирования химического состава природных вод, кислотно-основное равновесие в природных водоемах, окислительно-восстановительные процессы в гидросфере. Приводимое в учебном пособии краткое изложение разделов физико-химических процессов, протекающих в гидросфере, примеры решения типовых задач, вопросы для самопроверки и контрольные задачи должны способствовать повышению эффективности самостоятельной работы студентов. Пособие может быть использовано студентами при отработке теоретического материала после прослушивания лекций, подготовке к практическим и семинарским занятиям. Данное пособие составлено кандидатом химических наук Дмитриенко Т.Г.
Рецензенты: доктор химических наук, профессор Древко Б.И. кандидат химических наук, доцент Ястребова Н.И.
ã Саратовский военный институт радиационной, химической и биологической защиты, 2006 ФИЗИКО-ХИМИЧЕСКИЕ ПРОЦЕССЫ В ГИДРОСФЕРЕ
Гидросфера – прерывистая водная оболочка Земли. В настоящее время под понятием гидросферы объединяют все виды природных растворов, в воду,находящуюся в трех различных агрегатных состояниях (твердом, жидком и газообразном), и воду, которая входит в состав химических соединений. В большинстве своем природные воды представляют собой неравновесные, открытые (с точки зрения термодинамики) системы. Исключение составляют лишь отдельные ограниченные объемы подземных вод. Однако для описания процессов, протекающих в природных водах, часто используют законы равновесной термодинамики.
Аномальные свойства воды и состав природных вод
Общие запасы воды на Земле составляют 1385 984 610 км3. Но не в связи с огромным количеством, а исключительно благодаря ряду аномальных характеристик соединение водорода с кислородом Н2О выделено в самостоятельную земную оболочку. Среди аномальных свойств воды, играющих важную роль в поддержании жизни на Земле, нужно отметить следующие. Аномальный вид температурной зависимости плотности воды.Максимум плотности воды наблюдается при температуре около 4°С. Так, при 0°С дистиллированная вода имеет плотность 0,999841 кг/м3, при 25°С – 0,9977047 кг/м3, а при 4°С плотность дистиллированной воды составляет 0,999973 кг/м3. Благодаря этому с наступлением морозов поверхностный слой воды, охлажденный до 4оС, как более тяжелый опускается на дно водоема, вытесняя более теплые и легкие слои на поверхность. В дальнейшем, когда весь водоем охладится до 4°С. будет охлаждаться только поверхностный слой, который как более легкий будет оставаться на поверхности водоема. Лед легче воды, и он будет плавать на поверхности водоема. Лед и покрывающий его снег являются хорошей защитой водоема от промерзания, так как обладают малой теплопроводностью. Так, например, свежевыпавший снег при температуре 273 К имеет теплопроводность l = 90 . 10–3 Вт/(м . К), а теплопроводность уплотненного снега близка к теплопроводности строительного войлока, которая составляет l = 44 . 10–3 Вт/(м . К). Это способствует сохранению жизни в водоемах средних и высоких широт в зимнее время. Теплоемкость воды.Удельная теплоемкость воды выше, чем у всех твердых и жидких веществ, за исключением жидкого аммиака и водорода; при 273 К Ср = 75,3 Дж/(моль . К). Благодаря огромной теплоемкости воды океаны сглаживают колебания температуры, и перепад температур от экватора до полюса в Мировом океане составляет всего 30 К. Удельная энтальпия плавления.Значение удельной энтальпии плавления воды, равное Удельная энтальпия испарения.Высокое значение удельной энтальпии испарения ( Поверхностное натяжение.Аномальновысокое поверхностное натяжение воды (s= 71,9 . 10–3 Дж/м2 при 298 К) приводит к появлению ряби и волн на водной поверхности уже при слабом ветре. В результате этого резко возрастает площадь водной поверхности и интенсифицируются процессы теплообмена между атмосферой и гидросферой. С высоким поверхностным натяжением воды связаны и капиллярные силы, благодаря действию которых вода способна подниматься на высоту до 10-12 мот уровня грунтовых вод. Диэлектрическая проницаемость.Диэлектрическая проницаемость воды имеет аномально высокое значение, равное 78,3 при 298 К. Это определяет самую большую растворяющую способность воды по отношению к веществам с полярной и ионнойструктурой. Поэтому в природе нет химически чистой воды, человек всегда имеет дело с растворами. Даже самые чистые атмосферные осадки над Антарктидой содержат до 5 мг/л растворенных солей. А содержание солей в дождевой воде в районах с интенсивной вулканической деятельностью достигает 1000 мг/л. Главнейшими природными соединениями, определяющими в основном состав природных вод, являются: галит – NaCl, гипс – CaSО4 . 2Н2О, кальцит – СаСО3 и доломит – CaMg(CO3)2. При контакте природной воды с галитом в раствор переходят катионы натрия и анионы хлора. При этом резко увеличивается общее содержание растворенных веществ в природных водах. В некоторых случаях в подземных водах обнаруживается до 400 г/л NaCl. При контакте с гипсом в природных водах появляются катионы кальция и сульфат-ионы. Общее содержание солей в таких водах обычно составляет 2-3 г/л. Однако в случае совместного присутствия солей гипса и галита, которое наблюдается достаточно часто, общее солесодержание может достичь 6-7 г/л. При растворении имеющих широкое распространение в природе карбоната кальция и доломита в водном растворе образуются ионы кальция, магния и гидрокарбоната (процессы растворения карбонатных пород рассмотрены в последующих главах). При контакте с диоксидом углерода общее солесодержание в таких водах достигает 1 г/л. Поскольку основное количество воды на Земле содержится в Мировом океане (таблица 1), средний состав природных вод – растворов – близок к составу океанической воды. Таблица 1. Мировые запасы воды
В океанической воде обнаружены практически все элементы, но содержание их весьма различно. На восемь элементов – кислород (85,7%), водород (10,8%), хлор (1,93%), натрий (1,03%), магний (0,13%), сера (0,09%), кальций (0,04%), калий (0,039%) – приходится 99,78% массы воды Мирового океана. Все остальные элементы в сумме составляют менее 1% от массы гидросферы. Среди катионов, присутствующих в воде Мирового океана (таблица 2), преобладающими являются (в порядке убывания концентрации): Na+ > Mg2+ > Ca2+ > К+ Из анионов в воде Мирового океана преобладают:
В воде открытого океана независимо от абсолютной концентрации количественные соотношения между главными компонентами основного солевого состава всегда постоянны. Эта зависимость впервые была доказана экспериментально по результатам многочисленных анализов проб воды, взятых в различных частях Мирового океана, У. Дитмаром и получила название закон Дитмара. Таблица 2. Средний состав природных вод
* Для выражения концентрации примеси в растворах, как и для газов, используется понятие миллионной доли (млн–1, или – в англоязычной транскрипции – ррm), однако в случае растворов речь идет о массовой доле. Так, 1 млн–1 (маc.) означает содержание 1 г примеси в 1 т раствора. Уточнение «(маc.)» часто опускается. Благодаря закону Дитмара можно, определив экспериментально концентрацию лишь одного «реперного» компонента, рассчитать содержание остальных ионов. В качестве такого «реперного» компонента выбрана достаточно легко определяемая величина – хлорность. Под хлорностью воды подразумевают число граммов ионов хлора, эквивалентное сумме ионов галогенов, осаждаемых нитратом серебра, содержащееся в 1 кг воды. В качестве единиц измерения хлорности принято использовать промилле (тысячная доля. %о) (количество граммов на килограмм раствора). В речной воде среди катионов наиболее распространены: Са2+ > Na+ > Mg2+ > K+ а среди анионов
Для среднего состава дождевой воды преобладающим катионом является Na+, а анионом – Легко заметить, что для всех рассмотренных выше природных вод более 90% растворенных солей представлено одними и теми же анионами икатионами. Поэтому катионы Na+, Ca2+, Mg2+ и К+ называют главными катионами, а анионы НСО Для измерения содержания главных компонентов и примесей в природных водах помимо отмеченных выше массовых концентраций (млн–1, %, г/л и мг/л) часто используются такие единицы измерения, как моль/л, мкг/л, мг-экв./л, %-экв. Для удобства представления химического состава природных вод принято использовать запись не в виде таблиц, а в виде формулы. При этом состав воды записывают в виде дроби. В числителе дроби в порядке уменьшения концентрации записывают химические формулы всех анионов, в знаменателе – всех катионов. В формулу вносятся лишь те катионы и анионы, содержание которых превышает 1 %-экв. Вслед за химической формулой иона цифрами записывают его концентрацию, выраженную в проценто-эквивалентах. Слева перед дробью в виде химической формулы и числа, характеризующего концентрацию в мг/л, записывают содержание в воде растворимых примесей, а затем микроэлементов, если они представляют геохимический интерес. Далее указывают округленную величину общей минерализации воды (М), выраженную в г/л и деленную на сумму ммоль-экв. анионов в растворе. Справа от формулы принято записывать показатели, характеризующие рН и окислительно-восстанови-тельный потенциал воды (мВ), если они известны. Примеры решения задач
Пример 1. Выразите содержание главных катионов и главных анионов морской воды в промилле и миллимолях на литр. Решение. Приведенные в таблице 2 значения концентраций главных компонентов морской воды, выраженные в млн–1, показывают количество мг соответствующего иона на 1кг раствора. Концентрация, выраженная в промилле, характеризует количество граммов вещества в 1кг раствора. Для перевода концентрации, выраженной в млн–1, в промилле необходимо лишь уменьшить исходную концентрацию в тысячу раз: С(%) = С/(млн–1) . 10–3. Для выражения концентрации главных компонентов морской воды в миллимолях на литр следует значение концентрации соответствующего компонента, выраженное в промилле, разделить на его молярную массу и умножить на плотность воды, выраженную в кг на литр раствора, и на 1000 (для перевода молей в миллимоли): C// (ммоль/л) = С(%) . р (кг/л) . 1000/М/ (г/моль). Полученные значения концентраций удобно представить в виде таблицы:
* Плотность морской воды принята равной 1 кг/л. Ответ:представлен в таблице. Пример 2.Представьте в виде формулы средний состав морской воды, в которой содержание растворенного диоксида углерода составляет 1000 мг/л. Решение.Для решения задачи следует определить концентрации в %-экв. соответствующих примесей в воде и записать состав в соответствии с принятыми правилами в виде дроби. Поскольку %-экв. определяет долю (в %) концентрации соответствующей примеси, выраженной в моль-экв./л или в ммоль-экв./л, от общей концентрации в моль-экв./л или ммоль-экв./л суммы анионов или катионов, присутствующих в данном растворе, то прежде всего необходимо выразить концентрации анионов и катионов в ммоль-экв./л и найти их суммы. Для перевода концентрации в ммоль-экв./л необходимо разделить значение концентрации компонента, выраженное в ммоль/л (Пример 1), на соответствующий фактор эквивалентности: Сi (ммоль-экв./л) = Сi (моль/л)f , где f – фактор эквивалентности, который равен 1/2 для двухзарядных анионов и катионов и 1 для однозарядных ионов. Hа следующем этапе определим суммарныеконцентрации анионов и катионов в ммоль-экв./л и процентное содержание концентрации каждого иона от соответствующей суммы. Полученные значения представляют собой концентрацию, выраженную в %-экв. Результаты вычислений для анионов и катионов морской воды представлены в таблице:
Значение минерализации воды можно принять равным сумме концентраций примесей, выраженных в г/л. Для определения концентрации примесей в г/л следует умножить соответствующее значение, выраженное в ммоль/л, на молярную массу иона и разделить на 1000: Величина минерализации воды в рассматриваемом случае при округлении до целого грамма равна 35. Состав морской воды в виде формулы можно представить как дробь, в числителе которой в порядке уменьшения концентрации записаны химические символы всех анионов, кроме
Ответ:см. формулу. Пример 3.Оцените, сколько граммов поваренной соли (NaCl) содержится в 1 кг морской воды, отобранной в одном из заливов Баренцева моря, еслиее хлорность равна 15%? Решение.Соотношение основных компонентов морской воды под действием материкового стока может незначительно меняться. Однако для проведения оценки этими изменениями можно пренебречь и для решения задачи воспользоваться законом Дитмара. Как было показано в Примере 2.2, содержание ионов натрия в морской воде составляет 459,1 ммоль/л, а содержание ионов хлора – 534,6 ммоль/л, следовательно, часть ионов хлора в морской воде связана с другими катионами. Поэтому для определения содержания NaCl в воде залива необходимо определить концентрацию катионов натрия в этой воде. В соответствии с законом Дитмара соблюдается равенство отношения концентраций ионов натрия и хлора для среднего состава морской воды и воды из залива Баренцева моря:
где Отсюда легко определить содержание ионов натрия в воде залива (С C/Na =CNaC/Cl/CCl = 10,56 . 15,00 : 18,98 = 8,34 (%). Следовательно, в 1 кг воды из залива Баренцева моря содержится 8,34 г катионов натрия. Зная молярную массу NaCl, найдем массу поваренной соли, содержащейся в 1кг воды из залива: mNaC1 = MNaClC/Na/MNa = 58,5 . 8,34 : 23,0 = 21 (г/кг). Ответ:в 1кг воды из Баренцева моря содержится 21г NaCl.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Физико-химические процессы в гидросфере: Учебное пособие. – Саратов: СВИРХБЗ, 2006. – 103 с.
Физико-химические процессы в гидросфере: Учебное пособие. – Саратов: СВИРХБЗ, 2006. – 103 с.
 Нпл= 6,012 кДж/моль при 273 К, является наиболее высоким среди твердых и жидких тел, за исключением аммиака и водорода. Благодаря высокой теплоте плавления на Земле сглаживаются сезонные переходы; весну и осень в средних и высоких широтах можно рассматривать как сезон фазовых переходов воды. Сравнительно легко нагреваясь или охлаждаясь до 0°С, вода, снег и лед для перехода в другое агрегатное состояние требуют значительных расходов энергии, поэтому эти переходы обычно растягиваются во времени. Следует отметить, например, что при замерзании 1м3 воды выделяется столько же тепла, сколько при сжигании примерно 10 кг угля.
Нпл= 6,012 кДж/моль при 273 К, является наиболее высоким среди твердых и жидких тел, за исключением аммиака и водорода. Благодаря высокой теплоте плавления на Земле сглаживаются сезонные переходы; весну и осень в средних и высоких широтах можно рассматривать как сезон фазовых переходов воды. Сравнительно легко нагреваясь или охлаждаясь до 0°С, вода, снег и лед для перехода в другое агрегатное состояние требуют значительных расходов энергии, поэтому эти переходы обычно растягиваются во времени. Следует отметить, например, что при замерзании 1м3 воды выделяется столько же тепла, сколько при сжигании примерно 10 кг угля. другие катионы
другие катионы другие анионы.
другие анионы.

 другие анионы.
другие анионы.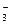 , SO
, SO  , иСl– – главными анионами природных вод.
, иСl– – главными анионами природных вод. .
. ,
, и
и  – концентрация (%) ионов натрия и хлора для среднего состава морской воды и воды залива соответственно.
– концентрация (%) ионов натрия и хлора для среднего состава морской воды и воды залива соответственно. ), принимая концентрацию ионов хлора в воде залива (C/Cl) равной значению хлорности этой воды и концентрации ионов натрия и хлора в % равными значениям для среднего состава морской воды (Пример 1):
), принимая концентрацию ионов хлора в воде залива (C/Cl) равной значению хлорности этой воды и концентрации ионов натрия и хлора в % равными значениям для среднего состава морской воды (Пример 1):