
|
|
Растворимость карбонатов и рН подземных и поверхностных природных вод
Карбонаты широко распространены как в донных отложениях морей и океанов, так и на поверхности материков. Мощные толщи известняков, мергелей и других карбонатных пород встречаются практически повсеместно. Среди солей угольной кислоты (карбонатов) наиболее распространенным в природе является карбонат кальция. Карбонат кальция в природе встречается в виде двух кристаллических форм – кальцита и арагонита. Кальцит (кристаллы ромбоэдрической формы гексагональной сингонии) распространен значительно шире и наиболее характерен для осадков, образующихся в холодной среде. Арагонит (орторомбоэдрическая форма), образующийся в тропических морях, относится к метастабильной форме карбоната кальция и постепенно переходит в кальцит. Процесс непосредственного растворения карбоната кальция по уравнению
практически не играет роли при переходе малорастворимых карбонатов в раствор. Соли угольной кислоты в природных водоемах могут переходить в раствор и существовать в нем в заметных количествах только при наличии растворенного диоксида углерода:
Образующиеся при этом анионы включаются в общую систему карбонатных равновесий, существующую в природных водах, и оказывают существенное влияние на рН растворов. Рассмотрим в качестве примера зависимость рН растворов карбоната кальция в воде от парциального давления диоксида углерода над системой при условии отсутствия других ионов в растворе. В рассматриваемой системе карбонатных равновесий имеем пять переменных: [HCO [Н+] + 2[Са2+] = [HCO Основываясь на экспериментальных данных о величине рН растворов СаСО3, в дальнейших расчетах будем рассматривать только область растворов с рН < 9. В этой области [Н+], [ОН–] и 2[СО 2[Са2+] = [НСО С учетом коэффициентов активности ионов Са2+ и НСО
где Таким образом, для определения зависимости концентрации ионов водорода в растворе карбоната кальция от парциального давления углекислого газа над раствором необходимо решить систему уравнений:
Решая эту систему методом подстановок, получим
Далее расчет концентрации ионов водорода в растворе при определенном парциальном давлении СО2 следует проверить методом последовательных приближений. На первой ступени коэффициенты активности ионов кальция и гидрокарбонат-ионов принимают равными друг другу. При этом определяют концентрацию ионов водорода и всех других ионов в растворе и затем по уравнению Дебая – Хюккеля рассчитывают коэффициенты активности ионов Са2+ и НСО Для большей части поверхностных вод на Земле парциальное давление диоксида углерода над растворами колеблется от 10–7 до 10–8,5 Па. При равновесии с карбонатными породами в этих условиях рН поверхностных вод должен составлять 7,3-8,4. Из системы уравнений (37) можно определить зависимость между концентрацией ионов кальция в растворе и парциальным давлением углекислого газа над ним. Сделав необходимые преобразования, получим:
Полученное уравнение свидетельствует о том, что соотношение между концентрацией ионов кальция в растворе и парциальным давлением диоксида углерода над этим раствором нелинейно. Поэтому при смешении природных вод, равновесных с СаСО3, но имеющих различное парциальное давление СО2 над раствором, следует ожидать получения неравновесной по карбонату кальция смеси. В этом случае процесс смешения может сопровождаться растворением либо осаждением карбоната кальция. Помимо кальцита и арагонита в литосфере достаточно широко распространены карбонатные породы содержащие кальций и магний, – это доломит CaMg(CO3)2 и высокомагнезиальные кальциты. Кристаллическая структура доломита подобна структуре кальцита, за исключением того, что атомы Са и Mg расположены в различных плоскостях. Порядок расположения этих атомов отличает доломит от высокомагнезиального кальцита того же состава. Магнезиальные кальциты, образующиеся в районах морского мелководья, обычно содержат от 11 до 19%(мол.) MgCO3 и относятся к высокомагнезиальным кальцитам. Кальцит, содержащий менее 5%(мол.) MgCO3, называют низкомагнезиальным. Процесс растворения доломита можно представить следующим уравнением:
Константа равновесия этого процесса равна: Кд = Значение константы равновесия процесса растворения доломита, найденное экспериментально при изучении равновесий, установившихся в природных водах, длительное время находящихся в контакте с доломитовыми породами, составило Кд = 10–17. В природе возможно взаимное преобразование кальцита и доломита:
Константа равновесия этого процесса равна отношению активностей ионов магния и кальция: Кд-к = В случае, если отношение активностей ионов магния и кальция в растворе будет больше значения константы равновесия Кд_к реакции (42), кальцит будет переходить в доломит, и наоборот. Константу равновесия этого процесса можно определить по значениям константы растворения доломита (41) и кальцита (оценивается величиной 10–8,4): Кд-к = Это значение дает возможность предположить, что для большинства поверхностных вод кальцит – менее устойчивая форма карбонатных пород, чем доломит, при отношении концентраций [Mg2+]/[Ca2+] > 1. В реальных условиях кальцит редко преобразуется в доломит при низких температурах, если отношение концентраций [Mg2+]/[Ca2+] £10.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 СаСО3 Са2+ + CO
СаСО3 Са2+ + CO 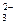 (32)
(32)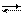 СаСО3 + СО2(р-р) Са2+ + 2НСО
СаСО3 + СО2(р-р) Са2+ + 2НСО 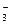 ], [СО
], [СО  , (36)
, (36) ,
,  – коэффициенты активности ионов кальция и гидрокарбоната.
– коэффициенты активности ионов кальция и гидрокарбоната.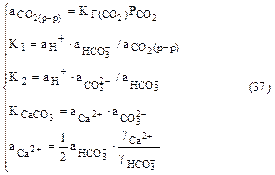
 . (38)
. (38) . (39)
. (39) CaMg(CO3)2 Са2+ + Mg2+ + 2СО
CaMg(CO3)2 Са2+ + Mg2+ + 2СО  (41)
(41) CaMg(CO3)2 +Са2+ 2СаСО3 +Mg2+ (42)
CaMg(CO3)2 +Са2+ 2СаСО3 +Mg2+ (42) (43)
(43) . (44)
. (44)