
|
|
Влияние температуры на положение равновесияПовышение либо понижение температуры означает приобретение либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия. Запишем уравнение –RTlnKp » DН
Продифференцировав выражение по температуре, получаем для зависимости константы равновесия от температуры уравнение – изобару Вант-Гоффа:
Изобара Вант-Гоффа связывает изменение константы химического равновесия с тепловым эффектом реакции в изобарных условиях. Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры. Экзотермические реакции: ΔH° < 0. В этом случае температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево. Эндотермические реакции: ΔH° > 0. В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо). Графики зависимостей константы равновесия от температуры для экзотермических и эндотермических реакций приведены на рис.
Рис. Зависимость константы равновесия от температуры. Действие рассмотренных факторов (давления, концентрации и температуры), равно как и любых других, на систему, находящуюся в состоянии равновесия, обобщает принцип смещения равновесия, называемый также принципом Ле Шателье. Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то равновесие сместится в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия (в системе возникает самопроизвольный процесс, компенсирующий данное воздействие).
. ФАЗОВЫЕ РАВНОВЕСИЯ Вещество при изменении давления и температуры может переходить из одного агрегатного состояния в другое. Эти переходы, совершающиеся при постоянной температуре, называют фазовыми переходами первого рода. Количество теплоты, которое вещество получает из окружающей среды либо отдает окружающей среде при фазовом переходе, есть скрытая теплота фазового перехода. Если рассматривается гетерогенная система, в которой нет химических взаимодействий, а возможны лишь фазовые переходы, то при постоянстве температуры и давления в системе существует т.н. фазовое равновесие. Фазовое равновесие характеризуется некоторым числом фаз, компонентов и числом степеней термодинамической свободы системы. Компонент – химически однородная составная часть системы, которая может быть выделена из системы и существовать вне её. Число независимых компонентов системы равно числу компонентов минус число возможных химических реакций между ними. Число степеней свободы – число параметров состояния системы, которые могут быть одновременно произвольно изменены в некоторых пределах без изменения числа и природы фаз в системе. Число степеней свободы гетерогенной термодинамической системы, находящейся в состоянии фазового равновесия, определяется правилом фаз, сформулированным Дж. Гиббсом: Число степеней свободы равновесной термодинамической системы С равно числу независимых компонентов системы К минус число фаз Ф плюс число внешних факторов, влияющих на равновесие. Для системы, на которую из внешних факторов влияют только температура и давление, можно записать: С = К – Ф + 2 Системы принято классифицировать по числу компонентов (одно-, двухкомпонентные и т.д.), по числу фаз (одно-, двухфазные и т.д.) и числу степеней свободы (инвариантные, моно-, дивариантные и т.д.). Для систем с фазовыми переходами обычно рассматривают графическую зависимость состояния системы от внешних условий – т.н. диаграммы состояния. Анализ диаграмм состояния позволяет определить число фаз в системе, границы их существования, характер взаимодействия компонентов. В основе анализа диаграмм состояния лежат два принципа: принцип непрерывности и принцип соответствия. Согласно принципу непрерывности, при непрерывном изменении параметров состояния все свойства отдельных фаз изменяются также непрерывно; свойства системы в целом изменяются непрерывно до тех пор, пока не изменится число или природа фаз в системе, что приводит к скачкообразному изменению свойств системы. Согласно принципу соответствия, на диаграмме состояния системы каждой фазе соответствует часть плоскости – поле фазы. Линии пересечения плоскостей отвечают равновесию между двумя фазами. Всякая точка на диаграмме состояния (т. н. фигуративная точка) отвечает некоторому состоянию системы с определенными значениями параметров состояния. Рассмотрим и проанализируем диаграмму состояния воды . Поскольку вода – единственное присутствующее в системе вещество, число независимых компонентов К = 1. В системе возможны три фазовых равновесия: между жидкостью и газом (линия ОА – зависимость давления насыщенного пара воды от температуры), твердым телом и газом (линия ОВ – зависимость давления насыщенного пара надо льдом от температуры), твердым телом и жидкостью (линия ОС – зависимость температуры плавления льда от давления). Три кривые имеют точку пересечения О, называемую тройной точкой воды; тройная точка отвечает равновесию между тремя фазами.
Рис. Диаграмма состояния воды В тройной точке система трехфазна и число степеней свободы равно нулю; три фазы могут находиться в равновесии лишь при строго определенных значениях температуры и давления (для воды тройная точка отвечает состоянию с Р = 6.1 кПа и Т = 273.16 К). Кривая ОВ теоретически продолжается до абсолютного нуля, а кривая давления насыщенного пара над жидкостью ОА заканчивается в критической точке воды (Tкр = 607.46 К, Ркр = 19.5 МПа); выше критической температуры газ и жидкость не могут существовать как отдельные фазы. Кривая ОС в верхней части (при высоких давлениях) изменяет свой наклон (появляются новые кристаллические фазы, плотность которых, в отличие от обычного льда, выше, чем у воды). Внутри каждой из областей диаграммы (АОВ, ВОС, АОС) система однофазна; число степеней свободы системы равно двум (система дивариантна), т.е. можно одновременно изменять и температуру, и давление, не вызывая изменения числа фаз в системе: С = 1 – 1 + 2 = 2 На каждой из линий число фаз в системе равно двум и, согласно правилу фаз, система моновариантна, т.е. для каждого значения температуры имеется только одно значение давления, при котором система двухфазна: С = 1 – 2 + 2 = 1. Кривая равновесия "твердое вещество – жидкость" на диаграммах состояния воды и висмута наклонена влево, а на диаграммах состояния остальных веществ – вправо. Это связано с тем, что плотность воды больше, чем плотность льда (и плотность жидкого висмута больше его плотности в твердом состоянии), т.е. плавление сопровождается уменьшением объема (ΔV < 0).
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ РАСТВОРОВ Существование абсолютно чистых веществ невозможно – всякое вещество обязательно содержит примеси, или, иными словами, всякая гомогенная система многокомпонентна. Если имеющиеся в веществе примеси в пределах точности описания системы не оказывают влияния на изучаемые свойства, можно считать систему однокомпонентной; в противном случае гомогенную систему считают раствором. Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойств. Раствор может иметь любое агрегатное состояние; соответственно их разделяют на твердые, жидкие и газообразные (последние обычно называют газовыми смесями). Обычно компоненты раствора разделяют на растворитель и растворенное вещество. Как правило, растворителем считают компонент, присутствующий в растворе в преобладающем количестве либо компонент, кристаллизующийся первым при охлаждении раствора; если одним из компонентов раствора является жидкое в чистом виде вещество, а остальными – твердые вещества либо газы, то растворителем считают жидкость. С термодинамической точки зрения это деление компонентов раствора не имеет смысла и носит поэтому условный характер. Как правило, процессы растворения сопровождаются изменением объема и температуры. Например, при смешении равных объемов этилового спирта и воды объем смеси меньше суммы объемов компонентов (это явление называется контракцией). Одной из важнейших характеристик раствора является его состав, описываемый с помощью понятия концентрация раствора. Ниже дается определение наиболее распространенных способов выражения концентрации и формулы для пересчета одних концентраций в другие: Если для разрушения структуры вещества необходимо больше теплоты, чем ее образуется при гидратации, то растворение - эндотермический процесс. Это происходит, например, при растворении в воде NаNОз, KCl, K2S04, NH4Cl и др. При работе с растворами необходимо знать их количественный состав. Количественный состав растворов выражается различными способами: 1. Массовая доля ω – число граммов растворенного вещества в 100 граммах раствора. Например, форма записи «раствор NaCl с массовой долей ω(NaCl) = 25%» означает, что 25 г NaCl содержится в 100 г раствора. Масса воды в нем равна 75 г Массовая доля растворенного вещества ω(Х) - безразмерная величина, равная отношению массы вещества m(Х) к массе раствора m(р-ра): ω(Х) = m(р-ра) = m(Х) + m(растворителя). Массовую долю выражают в долях единицы или в процентах. . 2. Молярная концентрация С(X) – число молей n растворенного вещества в одном литре раствора. Молярная концентрация равна отношению химического количества растворенного вещества (п(Х), моль) к объему раствора (V, л): С(Х) = Химическое количество вещества выражается соотношением n(Х) = где m(Х) - масса вещества Х, г; М(Х) - молярная масса вещества Х, г/моль. Подставляя формулу (3) в (2), получаем С(Х)=
Если известна масса т и плотность ρ раствора, то его объем V V= ρ m(р-ра)(5) Молярная концентрация выражается в моль/л или в моль/дм3 (эта размерность часто обозначается М). Например: 2 М NaOH или C(NaOH) = 2 моль/л. Данная форма записи означает, что 2 моля NaOH содержится в 1 л раствора. 3. Молярная концентрация эквивалента (нормальная концентрация) С( Молярная концентрация эквивалента равна отношению химического количества вещества эквивалента n( С( Молярная концентрация эквивалента выражается в моль/л или моль/дм3 (часто обозначается н.). Например: 2 н. Na2SO4 или С( Если взаимодействуют растворы веществ с известными нормальными концентрациями, то в точке эквивалентности справедливы соотношения: n( С( 4..Моляльная концентрация b – число молей растворенного вещества в одном килограмме растворителя. b (X) = где n(X) – число молей вещества X; m – масса вещества Х; М – молярная масса вещества Х; m(р-ля) – масса растворителя , кг. Измеряют моляльность в моль/кг. 5 Мольная доля χ –это отношение количества компонента, содержащегося в данной системе ( в молях), к общему количеству веществ в системе ( в молях). Выражают в долях единицы или процентах c(Х) = где n(Х) количество вещества Х в растворе, моль; ni – количество вещества каждого компонента раствора, моль. Для двухкомпонентного раствора 6 Очень часто в аналитической химии используют такой способ выражения концентраций раствора как титр: определяется числом граммов растворённого вещества в 1 мл раствора. Титрованные, или стандартные растворы – это растворы с точно известным содержанием вещества. Без таких растворов невозможно представить проведение химического анализа. Пример 1. Найти молярную концентрацию раствора с массовой долей 15% H2SO4 и плотностью 1,10 г/мл. Решение. Пусть Vр-ра = 1 л = 1000 мл. 1. Найдем массу 1 л раствора: m р-ра = rр-ра × Vр-ра = 1,10 г/мл × 1000 мл = 1100 г. 2. Найдем массу H2SO4 в 1 л раствора: m(H2SO4) = w × m р-ра = 0,15 × 1100 = 165 г. 3. Найдем молярную концентрацию: С H Пример 2. Сколько миллилитров 30%-ного раствора HCl (плотность 1,150 г/мл) нужно для приготовления 1 л 0,1 н. раствора HCl? Решение. 1. Найдем массу соляной кислоты, которая должна содержаться в приготовленном растворе: m(HCl) = C( где M( m(HCl) = 0,1 × 36,5 × 1 = 3,65 г. 2. Поскольку раствор готовят разбавлением водой 30%-го раствора, то такая же масса HCl должна содержаться в 30%-м растворе. Найдем массу 30%-го раствора, содержащую 3,65 г HCl: w(HCl) = 3. Найдем объем 30%-го раствора: V = Пример 3. Сколько граммов Na2SO4 × 10H2O надо растворить в 800 г воды, чтобы получить раствор с массовой долей Na2SO4 10%? Решение. Обозначим массу кристаллогидрата за х: m(Na2SO4 × H2O) = х(г), тогда w(Na2SO4) = Выразим массу Na2SO4, содержащуюся в х г кристаллогидрата, используя молярные массы М(Na2SO4) = 142 г/моль МNa 322 г Na2SO4 × H2O содержат 142 г Na2SO4, х г Na2SO4 × H2O содержат m г Na2SO4 m(Na2SO4) = Подставим m(Na2SO4) в выражение для w и найдем х: w(Na2SO4) = 142 × х = 0,1 × 322 × (800 + х) = 25 760 + 32,2х; 109,8х = 25 760, х = 234,6. m(Na2SO4 × H2O) = 234,6 г. Пример 4. Сколько граммов СаСО3 выпадет в осадок, если к 800 мл 0,5 н. раствора СаСl2 прибавить избыток раствора соды? Решение. При сливании растворов СаСl2 и соды (Nа2СО3) протекает реакция обмена: СаСl2 + Nа2СО3 = СаСО3¯ + 2NaCl. Для решения задачи будем использовать закон эквивалентов: при взаимодействии количества веществ эквивалентов разных веществ одинаковы, т.е. n( Найдем массу СаСО3, М m(СаСО3) = n( V = Концентрация компонента в растворе может изменяться от нуля до некоторого максимального значения, называемого растворимостью компонента. Растворимость S – концентрация компонента в насыщенном растворе. Насыщенный раствор – раствор, находящийся в равновесии с растворенным веществом. Величина растворимости характеризует равновесие между двумя фазами, поэтому на неё влияют все факторы, смещающие это равновесие (в соответствии с принципом Ле Шателье ). Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Количество тепла, поглощаемого или выделяемого при растворении 1 моля вещества, называется теплотой растворения (∆Hs). При растворении твердого вещества происходит разрушение кристаллической решетки. На это требуется затрата энергии. Однако многие процессы растворения протекают с выделением тепла, т.е. эти процессы являются экзотермическими. (∆Hs<0). Поэтому можно предположить, что наряду с разрушением кристаллической решетки протекает экзотермический процесс. Было показано, что этим процессом является сольватация, т.е. соединение молекул растворенного вещества в неустойчивые соединения – сольваты. Когда растворителем является вода, то эти соединения называются гидратами, а процесс – гидратацией. Поскольку молекула воды очень полярна, то многие гидраты весьма устойчивы и могут быть выделены в кристаллическом состоянии (кристаллогидраты), например CuSO4∙5H2O – медный купорос, Na2CO3∙10H2O – кристаллическая сода и др. В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачу. Очевидно, что чем больше концентрация раствора, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора. Поэтому количественная теория разработана только для идеальных растворов, единственной движущей силой образования такого раствора является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0. К идеальным можно отнести газовые растворы и растворы неполярных жидкостей, в которых энергия взаимодействия разнородных частиц EA-B близка к энергиям взаимодействия одинаковых частиц EA-A и EB-B. Идеальными можно считать также бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой. Свойства таких растворов зависят только от концентрации растворенного вещества, но не зависят от его природы. Растворимость газов в газах Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях (при очень высоких давлениях, когда плотность газов приближается к плотности жидкостей, может наблюдаться ограниченная растворимость). Газовые смеси описываются законом Дальтона: Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов. Pобщ. = SPi Pi = χi P
Растворимость газов в жидкостях Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов). Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0,017 л. азота, 748,8 л. аммиака или 427,8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона: Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются. Растворимость газов в жидкостях существенно зависит от температуры; Как правило, при растворении газа в жидкости выделяется теплота (DН Взаимная растворимость жидкостей В зависимости от природы жидкости могут смешиваться в любых соотношениях (в этом случае говорят о неограниченной взаимной растворимости), быть практически нерастворимыми друг в друге либо обладать ограниченной растворимостью. Рассмотрим последний случай на примере системы анилин – вода. Если смешать примерно равные количества воды и анилина, система будет состоять из двух слоев жидкости; верхний слой – раствор анилина в воде, нижний – раствор воды в анилине. Для каждой температуры оба раствора имеют строго определенный равновесный состав, не зависящий от количества каждого из компонентов.
Рис. 1.Диаграмма растворимости системы анилин – вода Зависимость концентрации растворов от температуры принято изображать графически с помощью диаграммы взаимной растворимости. Эта диаграмма для системы анилин-вода приведена на рис.1. Область под кривой – это область расслаивания жидкостей. Повышение температуры приводит к увеличению концентрации каждого из растворов (увеличению взаимной растворимости), и при некоторой температуре, называемой критической температурой расслоения (Ткр на рис..1) взаимная растворимость воды и анилина становится неограниченной. Система анилин – вода относится к т.н. системам с верхней критической температурой расслоения; существуют также и системы, для которых повышение температуры приводит к уменьшению взаимной растворимости компонентов. Растворимость твердых веществ в жидкостях Растворимость твердых веществ в жидкостях определяется природой веществ и, как правило, существенно зависит от температуры; сведения о растворимости твердых тел целиком основаны на опытных данных. Качественным обобщением экспериментальных данных по растворимости является принцип "подобное в подобном": полярные растворители хорошо растворяют полярные вещества и плохо – неполярные, и наоборот.
Рис. 2 Кривые растворимости некоторых солей в воде.
РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 – ТDS
– ТDS 




 (1)
(1) (2)
(2) (3)
(3)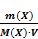 (4)
(4) X) – число молей эквивалентов растворенного вещества nэкв. в одном литре раствора.
X) – число молей эквивалентов растворенного вещества nэкв. в одном литре раствора. (4)
(4) Na2SO4) = 2 моль/л. Данная форма записи означает, что 2 моль эквивалента Na2SO4 содержится в 1 л раствора.
Na2SO4) = 2 моль/л. Данная форма записи означает, что 2 моль эквивалента Na2SO4 содержится в 1 л раствора. (Х)) = n(
(Х)) = n(  =
= 
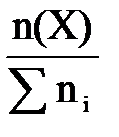 ,
, = n(Х) + n(S), где n(S) – количество вещества растворителя S. Мольная доля также выражается в долях единицы или процентах. Сумма массовых (мольных) долей всех компонентов раствора равна 1.
= n(Х) + n(S), где n(S) – количество вещества растворителя S. Мольная доля также выражается в долях единицы или процентах. Сумма массовых (мольных) долей всех компонентов раствора равна 1. SO
SO  =
=  =
=  = 1,68 моль/л.
= 1,68 моль/л.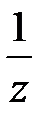 HCl) × M(
HCl) × M(  Þ mр-ра =
Þ mр-ра = 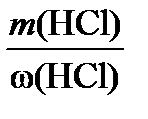 =
=  = 12,167 г.
= 12,167 г.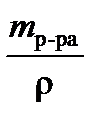 =
=  = 10,58 мл.
= 10,58 мл. =
=  = 0,1.
= 0,1. SO
SO  × H
× H  .
.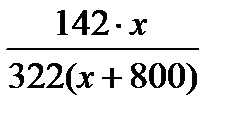 = 0,1;
= 0,1; × 100 г/моль:
× 100 г/моль: =
=  = 10,58 мл.
= 10,58 мл.
 < 0), поэтому с повышением температуры растворимость уменьшается.
< 0), поэтому с повышением температуры растворимость уменьшается.
