
|
|
Количественные характеристики процесса гидролиза соли.Количественными характеристиками процессов гидролиза являются степень гидролиза (b) и константа гидролиза (Кг). Степень гидролиза (b) отношение количества прогидролизовавшейся соли к общему количеству соли в растворе: b = Константа гидролиза – константа равновесия процесса гидролиза. Степень гидролиза (b) связана с константой гидролиза соли соотношением: Кг = Если b << 1, то равенство упрощается: Кг = b2Ссоли, тогда b = Упрощенной формулой нельзя пользоваться, если На величину степени гидролиза соли, кроме химической природы, влияют температура, концентрация соли и присутствие ионов Н+ или ОН-. Рассмотрим влияние указанных факторов на глубину протекания гидролиза на примере гидролиза соли Sn(NO3)2. Запишем уравнение гидролиза соли (образованной слабым основанием и сильной кислотой): Sn(NO3)2 + H2O Sn2+ + H2O Чтобы подавить гидролиз (уменьшить степень гидролиза) следует: а) охладить раствор. Гидролиз (реакция, обратная нейтрализации) – эндотермический процесс. При нагревании, в соответствии спринципом Ле Шателье, гидролиз усиливается. Следует отметить также, что при нагревании Kw увеличивается в большей степени, чем константы диссоциации кислот и оснований. б) увеличить концентрацию соли в растворе; в) подкислить раствор, т.е. ввести ионы Н+, одноименные образующимся при гидролизе. Чтобы усилить гидролиз этой соли, т.е. увеличить степень гидролиза следует: а) повысить температуру; б) разбавить раствор; в) ввести в раствор ионы ОН-, которые нейтрализуют ионы Н+, образуя воду, т.е. подщелочить раствор. 1) Для средних солей, образованных слабой кислотой и сильным основанием, константа гидролиза рассчитывается по формуле: Кг = Например: Na2SO3 + H2O « NaHSO3 + NaOH; SO Кг = 2) Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза рассчитывается по формуле: Кг = Например: Ni(NO3)2 + H2O Ni2+ + H2O Кг = 3) Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза рассчитывается по формуле: Кг = Например: СН3СООNH4 + H2O Кг = В растворах кислых солей для определения рН раствора необходимо сопоставить соответствующие константы гидролиза и диссоциации кислотного остатка. Такое сопоставление показывает, что в растворе гидрокарбоната натрия рН > 7, тогда как в растворе гидросульфита натрия рН < 7. Рассмотрим примеры задач, связанных с расчетами характеристик процессов гидролиза. ПРИМЕР 1. Вычислить константу гидролиза, степень гидролиза и рН 0,1 М раствора Na2SO3. РЕШЕНИЕ.
Гидролизу подвергается анион слабой кислоты: SO в молекулярной форме: Na2SO3 + H2O Рассчитываем константу гидролиза: Кг = (К2 Н b = Для определения рН раствора нужно определить равновесную концентрацию ионов ОН- в растворе, образующихся в результате гидролиза Na2SO3: СОН СОН рОН = -lgСОН рН = 14 – рОН = 14 – 3,90 = 10,10. ПРИМЕР 2. В растворе соли NH4Сl pH = 5,13 рассчитать молярную концентрацию соли, степень и константу гидролиза. РЕШЕНИЕ. Запишем диссоциацию соли:
Гидролизу подвергается катион слабого основания: NH в молекулярной форме: NH4Сl + H2O Рассчитываем константу гидролиза: Кг = (Кд NН СН тогда Ссоли = Степень гидролиза можно рассчитать исходя из формул: b =
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Бинарные соединения типа H2O, NH3, SO2 и другие называют соединениями первого порядка. Более сложные вещества, полученные взаимодействием соединений первого порядка,называют соединениями высшего порядка. Комплексными соединениями называются химические соединения высшего порядка, образованные взаимодействием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию в твердой, жидкой, газовой фазах. Чаще комплексообразование происходит в растворах. Комплексные соединения состоят из центрального атома (комплексообразователя), вокруг которого координируются нейтральные молекулы или ионы – так называемые лиганды. Лиганды связаны с центральным атомом донорно-акцепторной связью и образуют вместе с ним внутреннюю сферу комплексного соединения. Суммарное число связей центрального атома с лигандами характеризует координационное число. Комплексообразователь и лиганды заключают в квадратные скобки. Например, в комплексном ионе [Fe(CN)6]4‑ катион Fe2+- комплексообразователь, ионы CN‑ - лиганды, координационное число = 6. Заряд комплексной часцицы равен алгебраической сумме зарядов ее составных частей. В том случае, если заряд внутренней координационной сферы > 0, комплексная часцица представляет собой комплексный катион. Ионы, компенсирующие заряд внутренней координационной сферы, находятся во внешней координационной сфере. Например, в хлориде диамминсеребра(I) [Ag(NH3)2]Cl имеется комплексный катион [Ag(NH3)2]+, а внешняя координационная сфера представлена хлорид-ионом. В том случае, если заряд внутренней координационной сферы < 0, комплексная часцица представляет собой анион. В составе гексацианоферрата(III) калия K3[Fe(CN)6] имеется комплексный анион [Fe(CN)6]3-, а внешняя координационная сфера представлена ионами калия. Первую номенклатуру комплексных соединений разработалосновоположник координационной теории А. Вернер. По номенклатуре Вернера, или классической номенклатуре, для составления названия комплексного соединения используют следующие правила: 1. Называя комплексное соединение, сначала называют анион, а затем катион. 2. В названии аниона сначала указывают лиганды, а затем центральный атом. 3. Если лиганды различны по составу, то сначала называют отрицательно заряженные, затем нейтральные, а потом положительно заряженные лиганды. 4. Число лигандов указывается греческими цифрами: моно- , ди-, три-, тетра-, пента-, гекса-.Соотношение между степенью окисления комплексообразователя и координационным числом:
5. К названию отрицательно заряженного лиганда добавляется окончание –о: циано- (CN-), тиосульфато- (S2O3 2-), гидроксо- (OH-), нитрито- (NO2-), оксалато- (C2O42-), родано- (NCS-); нейтральные: аква- (H2O), аммин- (NH3), карбонил (CO). Если лиганд связан с центральным атомом одной связью, то он называется монодентатным, если двумя – бидентатным. Так, хлорид-ион – монодентатный лиганд, а SO42- – бидентатный. Если центральный атом входит в состав комплексного аниона, то к названию добавляется суффикс –ат, который добавляют к латинскому названию комплексообразователя: феррат (железо), купрат (медь), аргентат (серебро), аурат (золото), плюмбат (свинец), никколат (никель), станнат (олово), манганат (марганец), меркурат, гидраргират (ртуть). Комплексные катионы и нейтральные комплексные молекулы не имеют отличительных суффиксов. Для указания комплексообразователя используются русские названия соответствующих элементов. В настоящее время для построения названия комплексного соединения используется международная номенклатура, предложенная ИЮПАК. При построении названия комплексного соединения используются те же правила, что и по классической номенклатуре, кроме одного. Степень окисления центральногоатома указывается в скобках римской цифрой после названия комплексообразователя. Лиганды, одинаковые по заряду, но разные по составу, записываются слева направо в соответствии с рядом неметаллов: H2O левее NH3. Многие органические лиганды имеют сложные формулы, пользоваться которыми при составлении формул комплексных соединений неудобно. В этих случаях используют буквенные сокращения вместо химических формул: 2,2-бипиридил C5H4N – bipy; карбамид (NH)2CO – ur; оксалато C2O42- – ox; пиридин C2H5N – py; этилендиамин NH2CH2CH2NH2 –en. Формулы комплексных соединений читают строго справа налево: Примеры. [Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины(II); (NH4)2[Pt(OH)2Cl4] – дигидроксотетрахлороплатинат(IV) аммония; [Ag(NH3)2]ClO4 – перхлорат диамминсеребра (I), [Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II), [Pt(H2O)(NH3)2OH]NO3-нитрат гидроксодиамминакваплатины(II), [Pt(NH3)2Cl2] – дихлородиамминплатина (степень окисления платины не указывают, так как она определяется алгебраически, исходя из электронейтральности комплекса). Комплексные соединения, в состав которых входят комплексные ионы, называются комплексными электролитами. Диссоциация на ионы внешней координационной сферы и комплексные ионы (первичная диссоциация) протекает практически полностью, например: [Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl-; K3[Fe(CN)6] → 3K+ +[Fe(CN)6]3-. У комплексных неэлектролитов внешняя координационная сфера отсутствует. Примером комплексного неэлектролита является [Pt(NH3)2Cl2]. Диссоциация комплексной часцицы (вторичнаядиссоциация) протекает всегда частично; чем меньше это происходит, тем прочнее комплекс. Вторичная диссоциация комплексных соединений протекает ступенчато, процессы диссоциации равновесны, подчиняются закону действующих масс и количественно характеризуются константами диссоциации, которые называют константами нестойкости. Произведение ступенчатых констант нестойкости равно общей константе нестойкости: Кн = Кн1 · Кн2 · Кн3 · Кн4 · … Например, для комплексного иона [HgI4]2- ступенчатую диссоциацию можно показать следующим образом: [HgI4]2- ↔ [HgI3]- + I-, Кн1 = 5,9·10-3; [HgI3]- ↔ [HgI2] + I-, Кн2 = 1,66·10-4; [HgI2] ↔ [HgI]+ + I-, Кн3 = 1,1·10-11; [HgI]+ ↔ Hg2+ + I-, Кн4 = 1,35·10-13; ―――――――――――――――――――――――――――― [HgI4]2- ↔ Hg2+ + 4I-, Кн = 1,5·10-30. Константы нестойкости зависят от природы комплексного иона и от температуры. Их значения приведены в таблицах справочной литературы. Процесс образования комплексной часцицы характеризуется величиной, обратной Кн, называемой константой устойчивости: Ку = 1/ Кн. Константа нестойкости связана с изменением энергии Гиббса уравнением ∆G°т = -RTlnКн. Получают комплексные соединения при взаимодействии солей с лигандами: AgCl + 2NH3 = [Ag(NH3)2]Cl FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl Комплексные часцицы при определенных условиях могут разрушаться. Такими условиями могут быть нагревание, изменение рН растворов, добавление различных реагентов, которые могут привести к образованию либо новых более устойчивых комплексов, либо будут разрушать комплекс за счет образования малорастворимых электролитов, либо приведут к окислительно-восстановительному процессу с участием комплексов: 2[Cu(NH3)2]Cl + K2S = CuS↓ + 2KCl + 4NH3 K2[CoCl4] + 6H2O = [Co(H2O)6]Cl2 + 2KCl ПРИМЕР 1. Вычислить концентрацию ионов цинка в растворе тетрацианоцинката натрия с концентрацией 0,3 моль/л при избытке цианид-ионов, равном 0,01 моль/л РЕШЕНИЕ. Первичная диссоциация комплексного соединения протекает практически полностью: Na2[Zn(CN)4] → 2Na+ +[Zn(CN)4]2-. Cуммарный процесс вторичной диссоциации комплексного иона: [Zn(CN)4]2- Запишем для этого процесса выражение константы химического равновесия, оно равно константе нестойкости [Zn(CN)4]2- : CZn2+ · C4 CN- Кн = --------------- , где Кн = 2,4·10-20 (из таблицы). C[Zn(CN)4]2- Поскольку концентрация цианид-ионов, образующихся в результате диссоциации комплексного иона, значительно меньше концентрации введенного избытка, можно считать, что C(CN-) в равновесной системе равна 0,01 моль/л, т.е. концентрацией цианид-ионов, образующихся в результате диссоциации комплексного иона, можно пренебречь. Подставив известные из условия задачи значения, получаем: 2,4·10-20 0,3 С(Zn2+) = ----------------- = 7,2·10-13 моль/л. (0,01)4 ПРИМЕР 2. При какой концентрации ионов хлора начнет выпадать осадок AgCl из 0,1 М раствора [Ag(NH3)2]NO3, содержащем 1 моль аммиака в 1 л раствора? РЕШЕНИЕ. Образование осадка AgCl возможно при условии, что произведение концентраций, образующих осадок ионов Ag+ и Cl- превышает значение произведения растворимости AgCl: ПС (AgCl) > ПР(AgCl) или С(Ag+)·С(Cl-) > ПР(AgCl). Отсюда ПР(AgCl) С(Cl-) > --------------. С(Ag+) Ионы Ag+ образуются в растворе за счет диссоциации комплексного иона: [Ag(NH3)2]+ Равновесную концентрацию ионов серебра обозначим С(Ag+), равновесная концентрация аммиака, образующаяся при диссоциации комплексного иона будет в два раза больше и составит 2С(Ag+), равновесная концентрация комплексного иона 0,1 - С(Ag+), так как исходная концентрация комплексных ионов совпадает с исходной концентрацией раствора комплексной соли. Поскольку концентрация молекул аммиака, образующихся в результате диссоциации комплексного иона, значительно меньше концентрации избыточного аммиака, содержащегося в растворе комплексной соли, можно считать, что C(NH3) = 1 моль/л, т.е. концентрацией молекул аммиака, образующихся в результате диссоциации комплексного иона, пренебрегаем. Подставив значение C(NH3) в выражение Кн, получим значение С(Ag+): CAg+ · C2 NH3 CAg+· 12 CAg+ Кн = --------------- или 9,31·10-8 = -------- = ------------. C[Ag(NH3)2]+ 0,1 0,1 Откуда CAg+ = 9,31·10-9моль/л. ПР(AgCl) 1,56·10-10 С(Cl-) > -------------- > -------------- = 1,68·10-2 моль/л. С(Ag+) 9,31·10-9моль При концентрации хлорид-ионов больше 1,68·10-2 моль/л из раствора комплексной соли начнет выпадать осадок AgCl.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
. .
. .
. ³ 102.
³ 102.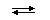 SnOHNO3 + HNO3;
SnOHNO3 + HNO3; (Kw = 10-14 – ионное произведение воды).
(Kw = 10-14 – ионное произведение воды). + H2O
+ H2O  + OH-;
+ OH-; .
. .
. .
. .
. .
. =
=  = 1,61 × 10-7
= 1,61 × 10-7 SO
SO  = 6,2 × 10-8 берем из справочника).
= 6,2 × 10-8 берем из справочника). = 1,27 × 10-3.
= 1,27 × 10-3. = С0 × b или СОН
= С0 × b или СОН  .
. = 1,27 × 10-4 моль/л, тогда
= 1,27 × 10-4 моль/л, тогда + Сl -
+ Сl -
 =
=  = 5,56 × 10-10
= 5,56 × 10-10 OH = ,8 × 10-5 берем из справочника). Используя формулу СН
OH = ,8 × 10-5 берем из справочника). Используя формулу СН  =
=  , найдем концентрацию соли, предварительно по значению рН определим СН
, найдем концентрацию соли, предварительно по значению рН определим СН  =
=  » 0,1 моль/л.
» 0,1 моль/л. . b =
. b =  = 7,4 × 10-5.
= 7,4 × 10-5.