
|
|
Закон Авогадро и молярный объем газа(1811 г.) Газообразное состояние вещества отличается от конденсированного (жидкого и твердого) сравнительно большими расстояниями между молекулами. На одну молекулу газа приходится объем
= 3,72 10–26 (109)3 нм3 = 37,2 нм3 Следовательно, расстояние между молекулами в среднем составляют около Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул, одинаковое количество (молей) вещества. Закон справедлив только для газообразных веществ.
Следствия. 1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы. 2. При нормальных условиях (T = 273K, P = 1 атм ( 101,3 кПа)) 1 моль любого газа занимает объем 22,4 л. 3) Закон Авогадро позволяет определить М газа, нужно только знать его относительную плотность по другому газу. Относительная плотность показывает, во сколько раз 1 моль одного газа тяжелее (или легче) 1 моля другого газа. DA(B) = Mr(B) / Mr(A) = M(B) / M(A) Пример 1. Какой объем водорода при н.у. выделится при растворении 4,8 г магния в избытке соляной кислоты? Решение. Mg + 2HCl = MgCl2 + H2. При растворении 24 г (1 моль) магния в HCl выделилось 22,4 л (1 моль) водорода; при растворении 4,8 г магния –– Х л водорода. X = (4,8 • 22,4) / 24 = 4,48 л водорода Пример 1. 3,17 г хлора занимают объем, равный 1 л (при н.у.). Вычислить по этим данным молярную массу хлора. Решение. Находим массу 22,4 л хлора 1 л––3,17 г хлора 22,4 л–– Х г хлора X = 3,17 • 22,4 = 71 г Следовательно, молярная масса хлора = 71г/моль.
Пример2. Плотность некоторого газообразного вещества по водороду равна 17. Чему равна его плотность по воздуху (Мвозд.=29). Решение. Мв-ва= 2D(H2) = 34г/моль. Dвозд = Пример3. Определить плотность по воздуху смеси азота, аргона и углекислого газа, если массовые доли компонентов составляют 15, 50 и 35% соответственно. Решение. Mсмеси = (15 28 + 50 40 + 35 44) / 100 = (420 + 2000 + 1540) / 100 = 39,6г/моль. Dсмеси(по воздуху) = Mсмеси / 29 = 39,6 / 29 = 1,37 Пример4.М газа можно определить, зная плотность г/л и умножить на 22,4 л. Если плотность Н2 при н.у. r(Н2) = 0,089 г/л, то его молярная масса М(Н2) = rV. M = 0,089 г/л × 22,4 л/моль = 2 г/моль Газовые законы строго выполняются лишь для идеальных газов, в котором молекулы не имеют объема (т.е. представляют собой материальные точки) и сталкиваются между собой упруго. Так как в природе идеального газа нет, газовые законы имеют приближенный характер.
P1V1 / T1 = P2V2 / T2 И, наоборот, из объединенного газового закона при P = const (P1 = P2) можно получить V1 / T1 = V2 / T2 (закон Гей-Люссака); при Т= const (T1 = T2): P1V1 = P2V2 (закон Бойля-Мариотта); при V = const P1 / T1 = P2 / T2 (закон Шарля).
Объединенный газовый закон - объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение,называемое уравнением Менделеева –Клайперона, которое можно записать так: РV = nRT = если условия отличаются от нормальных. В СИ единицы Р – Па, V – м3, n – число моль, Т – К, m – кг, М – кг/моль, то R = 8,314 Дж/(моль × К) (или 0,082 л атм/(моль • К)).
Пример. Какой объем займет при температуре 17°C и давлении 250 кПа оксид углерода (II) массой 84 г? Решение. Для данной массы конкретного газа отношение m / M постоянно, поэтому из уравнения Менделеева – Клайперона получается объединенный газовый закон. Из объединенного газового закона Бойля-Мариотта и Гей-Люссака: (P · V) / T = (P0 V0) / T0 Следует
Средняя молекулярная масса смеси газов равна общей массе смеси, деленной на общее число молей: Mср = (m1 +.... + mn) / (n1 +.... + nn) = (M1 V1 + Mn · Vn) / (n1 +.... + nn)
Закон эквивалентов (Рихтер 1800г.): Все вещества реагируют в эквивалентных соотношениях или массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ:
Эквивалент - реальная или условная частица, которая в данной кислотно-основной реакции, в реакции ионного обмена равноценна одному молю атомарного (одному молю ионов) водорода или в окислительно-восстановительной реакции – одному молю электронов. Фактор эквивалентности fэкв(Х) – число, обозначающее долю реальной или условной частицы, которая в реакции ионного обмена равноценна одному молю атоматомарного (одному молю ионов) водорода или в окислительно-восстановительной реакции – одному молю электронов. Фактор эквивалентности (fэкв = Молярная масса эквивалента вещества М[ М( М( М( М( Например: М( М( М( Пример 1. Определить эквивалент Mg, зная, что 3 весовых части магния соединяются с 2 весовыми частями О. Mэ(Mg) 3 : 2 = ЭMg : 8 ЭMg = Пример 2. CaCl2 содержит 36% Са и 64%Cl. Определить эквивалент кальция, зная, что эквивалент хлора равен 35,5 36 : 64 = ЭСа : 35,5 ЭСа =

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
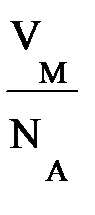 =
= 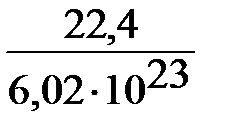 = 3,72 10–23 л = 3,72 10–26 м3 =
= 3,72 10–23 л = 3,72 10–26 м3 =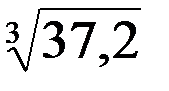 = 3,3 нм. Диаметр молекулы (Н2,О2,N2)составляет ~0,2–0,3 нм. Расстояние между молекулами приблизительно в 10 раз больше диаметра молекул, а объем, занимаемый некоторой порцей газа в 1000 раз меньше объема этой порции. Поэтому объем, занимаемый некоторым количеством газообразного вещества, определяется числом молекул в нем, а не размерами самих молекул, как это имеет место в жидкости и кристалле, где молекулы касаются друг друга.
= 3,3 нм. Диаметр молекулы (Н2,О2,N2)составляет ~0,2–0,3 нм. Расстояние между молекулами приблизительно в 10 раз больше диаметра молекул, а объем, занимаемый некоторой порцей газа в 1000 раз меньше объема этой порции. Поэтому объем, занимаемый некоторым количеством газообразного вещества, определяется числом молекул в нем, а не размерами самих молекул, как это имеет место в жидкости и кристалле, где молекулы касаются друг друга. =
= 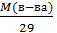 = 34 / 29 = 1,17
= 34 / 29 = 1,17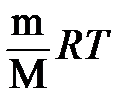 ,
,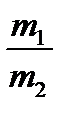 =
= 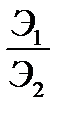
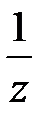 ) может равняться единице или быть меньше ее.
) может равняться единице или быть меньше ее. ;
; ;
;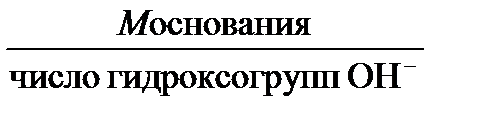 ;
; .
. × М(H
× М(H 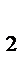 SO
SO  ) =
) = 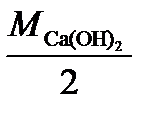 ;
;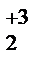 (SO4)3) =
(SO4)3) = 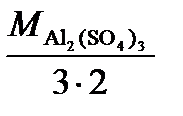 =
=  .
. = 12
= 12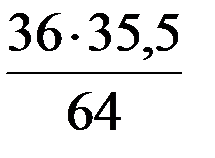 = 20
= 20