
|
|
Понятие активности растворенного веществаЕсли концентрация растворенного вещества не превышает 0,1 моль/л, раствор неэлектролита обычно считают разбавленным. В таких растворах взаимодействие между молекулами растворителя существенно преобладает над взаимодействием между молекулами растворителя и растворенного вещества, поэтому последним обычно можно пренебречь. В случае более концентрированных растворов такое приближение неправомерно и для формального учета взаимодействия частиц растворителя и растворенного вещества, а также частиц растворенного вещества между собой, вводится эмпирическая величина, заменяющая концентрацию – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f, который является мерой отклонения свойств реального раствора от идеального:
Как правило, коэффициент активности меньше единицы (при малых концентрациях считают f = 1 и а = С). Необходимо отметить, что активность компонента не прямо пропорциональна его концентрации – коэффициент активности уменьшается с увеличением концентрации.
Слабые электролиты. Константа диссоциации Распад растворенного вещества на ионы под действием молекул растворителя называется электролитической диссоциацией. Вещества, распадающиеся в растворах или расплавах на положительно и отрицательно заряженные ионы, называются электролитами. Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Кислоты, основания и соли являются электролитами. Все соли состоят из ионов, поэтому при растворении под действием полярных молекул воды происходит распад кристалла соли на ионы (катионы и анионы). Этот процесс сопровождается образованием акватированных (гидратированных) ионов в растворе: [Al2(SO4)3] + aq = 2{Al3+}aq + 3{SO или упрощенно: Al2(SO4)3 = 2Al3+ + 3SO Слабые многоосновные кислоты и слабые многокислотные основания диссоциируют ступенчато. Кислота: I ст. H2SO3 ⇄ Н+ + HSO II ст. HSO Основание: I ст. Mg(OH)2 ⇄ MgOH+ + OH-; II ст. MgOH+ ⇄ Mg2+ + OH-. Качественной характеристикой способности электролита к диссоциации является степень диссоциации (a). По значению степени диссоциации электролиты делят на сильные и слабые. К сильным относят те электролиты, у которых a ® 1. К слабым относят те электролиты, у которых a ® 0. Сильными электролитами в водных растворах являются почти все соли, некоторые кислоты (HCl, HBr, HI, HClO4, HMnO4, H2CrO4, H2SO4, HNO3, HClO3, H2SeO4) и гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Диссоциация сильных электролитов – необратимый процесс: HNO3 ® Н+ + NO Диссоциация слабых электролитов – обратимый процесс: HNO2 ⇄ H+ + NO Концентрация ионов в водных растворах сильных электролитов рассчитывается по формуле Сионов = a С n, (1) где a – степень электролитической диссоциации; С – концентрация электролита (моль/л); n – число ионов данного вида в одном моле электролита. В случае слабых электролитов: Сион. = a С. (2) В растворах слабых электролитов устанавливается равновесие между молекулами электролита и ионами, образовавшимися за счет диссоциации слабого бинарного электролита, например: СН3СООН ⇄ СН3СОО– + Н+. На основании закона действующих масс можно записать выражение константы равновесия: Kс = Константу равновесия Кс в данном случае называют константой диссоциации и обозначают К. Константа диссоциации электролита связана со степенью диссоциации соотношением, которое является математическим выражением закона разбавления Оствальда: K = где С0 – молярная концентрация растворенного электролита, моль/л. Выражение (4) применимо только для слабых электролитов. Этой формулой следует пользоваться для расчетов в случаях, когда отношение С/К £ 102 (a ³ 0,1). Если a << 1, то соотношение (1) упрощается: К » a2 С0. (5) Если a << 1, то a = Константы диссоциации слабых кислот и оснований приведены в справочниках. Зная значение константы диссоциации и концентрацию растворенного электролита, можно вычислить степень диссоциации. В неорганической химии чаще всего в качестве растворителя используется вода. Вода является слабым электролитом и диссоциирует с образованием ионов Н+ и ОН–: Н2О ⇄ Н+ + ОН–. Для чистой воды и разбавленных водных растворов электролитов произведение концентраций ионов водорода и гидроксид-ионов – величина постоянная, которая называется ионным произведением воды: Kw = CH Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением: АВ константа диссоциации выразится следующим соотношением: К = Для процесса диссоциации уксусной кислоты: CH3COOH K =
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например: H2CO3 HCO3– Первое равновесие – диссоциация по первой ступени – характеризуется константой KI = Для диссоциации по второй ступени: KII =
В случае угольной кислоты константы диссоциации имеют следующие значения: KI = 4,4∙10–7, KII = 4,7∙10–11. Для ступенчатой диссоциации всегда KI>KII>KIII>…, т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы. Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации α на общую концентрацию электролита С, выражение (13) в этом случае можно переписать следующим образом:
Для разбавленных растворов можно считать, что (1 – α) = 1. Тогда получаем:
Т.о., степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора; выражение (16) называют законом разбавления Оствальда. Степень диссоциации слабого электролита можно связать с изотоническим коэффициентом. Будем считать, что из N молекул электролита продиссоциировало n молекул, образовав νn ионов (ν – число ионов, на которое диссоциирует молекула). Поскольку изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации, получаем:
Соотношение (13) дает возможность, экспериментально определив изотонический коэффициент раствора, рассчитать степень диссоциации слабого электролита. В общем виде связь между коэффициентами і и a определяется уравнениями a = где n – число ионов, образующих молекулу данного электролита. Так, для NaCl ν= 2, для Al2(SO4)3 ν = 5 и т. д.
Сильные электролиты Предположение Аррениуса о том, что в растворе сильного электролита также существует динамическое равновесие между молекулами и ионами, как и у слабых электролитов, оказалось ошибочным. Экспериментальные исследования показали, что, во-первых, величина константы диссоциации сильного электролита зависит от концентрации (т.е. к растворам сильных электролитов неприменим закон действующих масс) и, во-вторых, никакими методами не удалось обнаружить в растворах сильных электролитов непродиссоциировавшие молекулы. Это позволило Н. Бьерруму сделать вывод, что сильные электролиты в растворах любых концентраций полностью диссоциируют на ионы и, следовательно, закономерности, полученные для слабых электролитов, не могут применяться к сильным электролитам без соответствующих поправок. Качественная теория сильных электролитов была разработана П. Дебаем и Г. Хюккелем (1923). Для сильных электролитов, полностью диссоциирующих на ионы, даже при малых концентрациях растворов энергия электростатического взаимодействия между ионами достаточно велика, и пренебречь этим взаимодействием нельзя. Взаимодействие противоположно и одноименно заряженных ионов (соответственно притяжение и отталкивание) приводит к тому, что вблизи каждого иона находятся преимущественно ионы с противоположным зарядом, образующие т.н. ионную атмосферу. Радиус ионной атмосферы сравнительно велик, поэтому ионные атмосферы соседних ионов пересекаются; кроме того, каждый ион окружен дипольными молекулами растворителя – сольватной оболочкой. Т.о., в растворе сильного электролита возникает подобие пространственной структуры, что ограничивает свободу перемещения ионов и приводит к изменению свойств раствора в том же направлении, как действовало бы уменьшение степени диссоциации. Поэтому, определяя степень диссоциации раствора сильного электролита, получают т.н. кажущуюся степень диссоциации, т.е. величину α с поправкой на межионное взаимодействие. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита. Количественные расчеты характеристик растворов сильных электролитов осуществляют с помощью понятий активности электролита аэ и активностей катионов и анионов а+ и а- соответственно, которые равны произведению коэффициента активности на концентрацию:
Для бинарного электролита средняя активность электролита связана с активностями ионов соотношением (16); подобным же образом связан средний коэффициент активности с ионными (17):
Дебаем и Хюккелем был разработан метод расчета среднего коэффициента активности сильного электролита. Для бинарного электролита уравнение имеет следующий вид:
Здесь z – заряд иона, для которого рассчитывается коэффициент активности, I – т.н. ионная сила раствора: некоторый параметр, который одновременно учитывает молярную концентрацию и заряд всех имеющихся в растворе ионов. Ионная сила раствора равна полусумме концентраций всех ионов, умноженных на квадрат их заряда:
Теория Дебая – Хюккеля применима только при концентрациях, не превышающих 0.05 моль/л. Для более концентрированных растворов сильных электролитов количественной теории не существует.
PН РАСТВОРОВ Жидкие протонсодержащие растворители вступают в обратимую реакцию самоионизации. Например, для воды: H2O + H2O Состояние равновесия в этом случае характеризуется ионным произведением воды Kw: Kw = C( При 22 оС Kw = 1 . 10--14 и C( Содержание ионов оксония H+] и гидроксид-ионов OH-- удобно выражать через водородный показатель рН и гидроксидный показатель рОН: рН = ‑lg C( При 22 оС в чистой воде рН = 7 и рОН = 7; рН + рОН = 14 = const = f(T). В водных растворах кислот среда кислотная. Это значит, что C( Раствор рН Раствор рН Концентрированная Дождевая вода 6,5 соляная кислота –1,1 Чистая вода при 25 С 7,0 1М раствор HСl 0,0 Раствор пищевой соды 8,5 Желудочный сок 1,4 Раствор буры 9,2 Лимонный сок 2,1 Известковая вода 10,5 Апельсиновый сок 2,8 Кровь 7,4 Томатный сок 4,1 1М раствор NaOH 14,0 Молоко 6,9 Насыщенный раствор ~15,0 NaOH
Нижняя и верхняя границы измерения рН водных растворов отвечают значениям рН = 1 и рН = 13 (рОН = 1), поскольку при рН < 1 и рН > 13 растворы перестают быть разбавленными. Наоборот, в предельно разбавленных растворах (при их бесконечно малой концентрации) значение рН стремится к семи и определяется диссоциацией самой воды. Ионное равновесие, как и любое другое, смещается при изменении концентрации одного из ионов. Например, если в раствор уксусной кислоты, диссоциирующей по уравнению CH3COOH ввести какую-либо соль этой кислоты и тем самым увеличить концентрацию ионов CH3COO–, то в соответствии с принципом Ле-Шателье равновесие смещается влево. Отсюда следует, что введение в раствор слабого электролита одноименных ионов (т.е. ионов, одинаковых с одним из ионов электролита) уменьшает степень диссоциации этого электролита Пример 1. Вычислить концентрацию ионов Н+, ОН- и рН раствора 0,1 н. H2SO4. Решение. H2SO4 – сильная кислота: H2SO4 = 2Н+ + SO Для сильных электролитов a = 1. В реакции диссоциации образуются 2 иона Н+. Молярная концентрация H2SO4 в два раза меньше ее нормальной концентрации и равна 0,05 моль/л. Концентрация ионов водорода равна: CH COH рН = -lgCH Пример 2. Вычислить концентрацию ионов Н+, ОН- и рН 0,1 М раствора HNO2. Решение. Запишем уравнение диссоциации кислоты: HNO2 Поскольку кислота слабая, степень диссоциации находим по формуле: a = При диссоциации кислоты образуются ионы Н+, концентрацию которых найдем по формуле: CH Концентрацию ионов ОН- определим из выражения ионного произведения воды: COH рН = -lgCH Пример 3. Определить степень диссоциации угольной кислоты в 0,01 М растворе, учитывая только первую ступень диссоциации, если рН этого раствора равен 4,17. Решение. Уравнение диссоциации кислоты: Н2СО3 Найдем концентрацию ионов Н+. Для этого найдем антилогарифм числа -4,17, т.к. рН = -lgCH CH Степень диссоциации найдем следующим образом: CH В растворах слабых электролитов многоосновных кислот и многокислотных оснований диссоциация преимущественно осуществляется по первой ступени и количество ионов Н+ или ОН- определяется этим процессом. Количеством ионов, образующихся при последующих ступенях диссоциации пренебрегают, так как оно незначительно. Пример 4. Вычислить рН 0,1 М НСООН, к 1 л которого добавлено 0,1 моль НСООNa. Запишем уравнение уравнения диссоциации слабого и сильного электролитов: НСООН НСООNa → Na+ + НСОО-; a = 1. Вклад в общую концентрацию формиат-ионов НСОО- в растворе процесса диссоциации кислоты очень мал (слабый электролит), поэтому СНСОО СНСОО Обозначим за х концентрацию ионов водорода в растворе: CH Равновесная концентрация кислоты за счет диссоциации изменится очень незначительно, поэтому принимаем её равной начальной: CНСООН = 0,1 моль/л. Тогда Кдис. = CH Водородный показатель: рН = -lgCH

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (8)
(8) }aq,
}aq,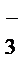 ;
;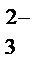 .
. .
. (3).
(3). , (4)
, (4) (6)
(6) × COH
× COH  = 10–14 (22oC) (7).
= 10–14 (22oC) (7).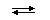 А+ + В–
А+ + В– (8).
(8).
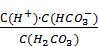

 (9)
(9) (10)
(10)  (11)
(11) (12)
(12) (13)
(13) (14)
(14) ;
;  ;
;  (15)
(15) (16)
(16) (17)
(17) (18)
(18)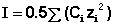 (19)
(19) )∙C(OH‑) = const = f(T)
)∙C(OH‑) = const = f(T)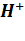 )∙ = C(OH‑) = 1 . 10--7 моль/л
)∙ = C(OH‑) = 1 . 10--7 моль/л )∙ и pOH = ‑lg C(OH‑)
)∙ и pOH = ‑lg C(OH‑) .
. =
=  = 1 × 10-13 моль/л;
= 1 × 10-13 моль/л; =
=  =
=  = 6,32 × 10-2, где КHNO
= 6,32 × 10-2, где КHNO 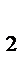 = 4 × 10-4.
= 4 × 10-4. = 1,58 × 10-10 моль/л.
= 1,58 × 10-10 моль/л. (I ступень).
(I ступень). = 10-4,17 = 6,76 × 10-5 моль/л.
= 10-4,17 = 6,76 × 10-5 моль/л. =
=  = 6,76 × 10-3.
= 6,76 × 10-3. = 1,8 × 10-4.
= 1,8 × 10-4. определяется процессом диссоциации соли, которая относится к сильным электролитам и диссоциирует практически нацело:
определяется процессом диссоциации соли, которая относится к сильным электролитам и диссоциирует практически нацело: = 1,8 × 10-4;
= 1,8 × 10-4;