
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции (ОВР) – это реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Изменение степеней окисления атомов элементов может происходить только в результате перехода электронов от одного атома к другому. Процесс отдачи электронов называется окислением. В процессе окисления степень окисления атома элемента повышается. Процесс присоединения электронов называется восстановлением. В процессе восстановления степень окисления атома элемента понижается. Процессы окисления и восстановления сопряжены, процесс окисления всегда сопровождается процессом восстановления, а процесс восстановления – окислением. Восстановителями называют атомы, молекулы или ионы, которые отдают электроны в процессе окисления. Восстановители в ОВР окисляются. Окислителями называют атомы, молекулы или ионы, которые присоединяют электроны в процессе восстановления. Окислители в ОВР восстанавливаются. В периодах периодической системы слева направо увеличивается окислительная способность атомов элементов, уменьшается их восстановительная способность. В главных подгруппах сверху вниз усиливается восстановительная способность атомов элементов и уменьшается их окислительная способность. Наиболее активными восстановителями являются металлы I и II групп, наиболее активными окислителями – неметаллы VI и VII групп (кислород, озон, галогены) (табл. 1). Таблица 1. Наиболее важные восстановители и окислители
Типы окислительно-восстановительных реакций приведены в табл.2.
Таблица 2. Типы ОВР
Расстановку коэффициентов в ОВР можно осуществить: 1) методом электронного баланса (для твердофазных реакций, реакций в газовой фазе, в растворах); 2) методом ионно-электронного баланса, или методом полуреакций (для реакций в растворах). При расстановке коэффициентов методом электронного баланса придерживаются следующих правил: 1. Записывают формулы исходных веществ, продуктов реакции и побочных продуктов химической реакции. Определяют элементы, атомы которых изменили свои степени окисления: KMn+7O4 + Na2S+4O3 + H2SO4 ® Mn+2SO4 + Na2S+6O4 + K2SO4 + H2O 2. Записывают уравнения электронного баланса, указывают окислитель и восстановитель. В уравнения записывают условные частицы (иногда реальные), заряд которых определяют исходя из правил определения степеней окисления:
3. Для установления баланса по электронам (число электронов, отданных восстановителем, равно числу электронов, принятых окислителем) полученные электронные уравнения умножают на наименьшие множители (соответственно 5 и 2 в приведенном примере). 4. Полученные коэффициенты переносят в уравнение реакции: 2KMnO4 + 5Na2SO3 + 3H2SO4 ® 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O. Если окисляемое вещество содержит два восстановителя, определяется общее число отданных электронов: Fe+2S
окислитель O 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 Ионно-электронный метод расстановки коэффициентов применяют при написании реакций, протекающих в растворе. При написании полуреакций окисления и восстановления этим методом используются символы частиц, реально существующих в растворе: MnO Ионно-электронный метод удобно использовать для реакций с участием веществ, в которых трудно определить степени окисления, например KCNS. Ионно-электронные схемы составляются по-разному в зависимости от характера среды, в частности по-разному выполняют баланс по кислороду (табл.3). Таблица 3.Выполнение баланса по кислороду
Главные этапы составления уравнений реакций ионно-электронным методом: 1. Записать формулы веществ, участвующих в химической реакции: NaNO2 + KMnO4 + H2SO4 ® NaNO3 + MnSO4 + K2SO4 + Н2О 2. Записать полуреакции окисления и восстановления. Уравнять число атомов всех элементов, кроме водорода и кислорода. 3. Уравнять кислород с использованием молекулы воды и ионов Н+ или ОН– в зависимости от среды (см.табл.3). 4. Уравнять число атомов водорода в левой и правой частях уравнения, используя ионы Н+ или ОН– и Н2О (в зависимости от среды). 5. Уравнять суммарные заряды ионов левой и правой частей уравнения, прибавляя или вычитая электроны. 6. Определить числа (множители), на которые необходимо умножить каждую из частиц соответствующих полуреакций и просуммировать полуреакции.
5NO 7. При наличии одинаковых частиц (ионов или молекул) в обеих частях суммарного ионно-молекулярного уравнения сократить их: 5NO 8. Полученные коэффициенты перенести в молекулярное уравнение: 5NaNO2 + 2KMnO4 + 3H2SO4 ® 5NaNO3 + 2MnSO4 + K2SO4 + 3Н2О. Чтобы написать уравнение ОВР, необходимо знать, как изменяются степени окисления элементов и в какие соединения превращается тот или иной окислитель или восстановитель. В зависимости от характера среды, концентрации растворов, температуры могут образовываться различные продукты ОВР. Так, в зависимости от характера среды образуются различные продукты при восстановлении перманганат-ионов MnO
Нейтральная среда (Н2О)
Щелочная среда (ОН–)
Например. 2KMnO4 + 5Zn + 8H2SO4 = 2MnSO4 + 5ZnSO4 + K2SO4 + 8Н2О 2KMnO4 + 3Na2SO3 + Н2О = 2MnO2 + 3Na2SO4 + 2KOH 2KMnO4 + 3Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + Н2О. Хром со степенью окисления +6 существует в форме аниона Cr2O
Кислая среда (Н+)
ОН- Н+
Щелочная среда (ОН–) Например. K2Cr2O7 + 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7Н2О Окисление соединений хрома со степенью окисления +3 приводит к образованию CrО 2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8Н2О. HNO3 окисляет большинство металлов и многие неметаллы. Благородные металлы (Au, Pt, Os, Ir) не реагируют с HNO3. Fe, Al, Cr не окисляются концентрированной азотной кислотой на холоду вследствие пассивации (образования на поверхности защитной оксидной пленки). При окислении металлы образуют нитраты, неметаллы окисляются до соответствующих высших кислот (Н3РО4, H2SO4, …), углерод – до СО2. При восстановлении HNO3 образуется смесь продуктов, в составе которых присутствует азот, при этом один из продуктов восстановления содержится в избытке. Его записывают в качестве продукта восстановления. Определяется продукт восстановления активностью металла и концентрацией кислоты: N+4O2 N+2O N активность металла восстановителя увеличивается HNO3 (конц.) HNO3 (разб.) концентрация кислоты уменьшается Например: Ag + 2HNO3(конц.) = AgNO3 + NO2 + H2O; 4Ca + 2HNO3(конц.) = 4Ca(NO3)2 + N2O + 5H2O; 4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O H2SO4(разб.) подобно HCl и другим кислотам, реагирует с металлами, которые расположены в электрохимическом ряду напряжений до водорода, ионы Н+ при этом восстанавливаются до Н2: Fe + H2SO4(разб.) = FeSO4 + Н2 H2SO4(конц.), как и HNO3, является кислотой – окислителем. H2SO4(конц.) реагирует также и с металлами, расположенными в электрохимическом ряду напряжений после водорода (Сu, Ag, Hg), с неметаллами. Не взаимодействуют с H2SO4(конц.) Au, Pt, Os, Ir; пассивируются на холоду Al, Cr, Fe. Продуктами восстановления H2SO4(конц.) могут быть: S+4O2 S0 H2S-2 увеличение активности восстановителя Например: 4Mg + H2SO4(конц.) = 4MgSO4 + H2S + 4H2O; Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O; C + 2H2SO4(конц.) = CO2 + 2SO2 + 2H2O. Галогены восстанавливаются в ОВР до галогенид-ионов, при восстановлении кислорода образуются продукты, степень окисления кислорода в которых –2: Br2 + H2S = S + 2HBr, O2 + 4Fe(OH)2 + 2H2O = 4Fe(OH)3 Кислородсодержащие кислоты галогенов и их соли обычно восстанавливаются до степени окисления –1, иногда до 0: KClO3 + 6FeSO4 + 3H2SO4 = KCl + 3Fe2(SO4)3 + 3H2O; HIO3 + 5HI = 3I2 + 3H2O. К сильным окислителям относятся соединения PbO2, MnO2, восстанавливающиеся до соединений со степенью окисления атомов металла +2: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O. Ионы металлов с более высокой степенью окисления (Fe+3, Co+3), выполняя функцию окислителей, восстанавливаются до ионов с более низкой степенью окисления: 2FeCl3 + H2S = 2FeCl2 + S + 2HCl. Ионы Н+ восстанавливаются до H2. Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды: Mg + 2HCl = MgCl2 + H2; 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2. Углерод окисляется кислородом до СО или СО2. При использовании углерода в качестве восстановителя в высокотемпературных процессах продуктом окисления, как правило, является СО вследствие протекания процесса СО2 + С = 2СО. Сера окисляется кислородом до SО2, фосфор – до Р2О3 или Р2О5, NO – до NO2, NН3, N2Н4 – до N2. В ряду галогенид-ионов Г– восстановительные свойства усиливаются от Cl– к І–, в кислой среде происходит окисление до Г2: KClO + 2KI + H2SO4 = I2 + KCl + K2SO4 + H2O. Ионы металлов с более низкой степенью окисления (Fe+2, Cu+, Sn+2, …) при взаимодействии с окислителями окисляются до соединений, в которых их степени окисления более высокие: 5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + MnCl2 + KCl + 4H2O. H2, являясь восстановителем, окисляется до ионов Н+. Гидрид-ионы Н– окисляются до H2: СаН2 + 2H2O = Са(ОН)2 + 2H2. Некоторые вещества, проявляют окислительно-восстановительную двойственность. Поэтому в присутствии окислителей с ярко выраженной окислительной способностью они проявляют восстановительные свойства, и наоборот: окисление восстановление Н2О (кислая среда) О2 Н2О2 ОН– (щелочная среда) окисление восстановление NO окисление восстановление SO
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ Для сравнения окислительно-восстановительных свойств окислителей и восстановителей используют стандартные электродные потенциалы. Наипростейший электрод представляет собой металлическую пластинку, опущенную в раствор соли этого же металла, например медная пластинка, опущенная в раствор CuSO4. Схематически электрод изображается следующим образом: записывают окисленную форму, потом через вертикальную черту, символизирующую границу межфазного раздела, восстановленную форму: CuSO4/CuилиCu2+/Cu. Пластинка металла и раствор электролита составляют единую окислительно-восстановительную систему, в которой устанавливается равновесие между окисленной и восстановленной формой: Cu2++ 2ē Если электрод изготовлен из активного металла и концентрация ионов металла в растворе меньше равновесной, то преобладает процесс перехода ионов металла в раствор, то есть равновесие (1) смещено влево. При этом металлическая пластинка заряжается отрицательно (Рис.А), так как электроны, образовавшиеся в процессе перехода ионов металла в раствор, остаются на пластинке (раствор не обладает электронной проводимостью). Гидратированные ионы металла притягиваются к отрицательно заряженной пластинке. Так образуется двойной электрический слой.
Если электрод изготовлен из неактивного металла, и металл опущен в раствор с концентрацией ионов большей, чем равновесная, равновесие (1) смещено вправо, то есть ионы металла будут переходить из раствора на металлическую пластинку. В этом случае поверхность металла заряжается положительно, а слой раствора возле пластинки – отрицательно (за счет избытка анионов в растворе) (Рис.В). Количественными характеристиками указанных процессов являются электродные потенциалы, которые различаются по знаку и величине. Абсолютное значение электродного потенциала экспериментально определить невозможно. Можно определить разность потенциалов между двумя электродами, одним из которых является электрод сравнения. В качестве электрода сравнения, по отношению к которому определяют потенциалы других электродов, принят стандартный водородный электрод. Стандартный водородный электрод представляет собой стеклянный сосуд, в который помещают платиновую пластинку, покрытую платиновой чернью (рыхлой пористой платиной с большой поверхностью для сорбции газообразного водорода). Сосуд заполняется раствором серной кислоты с концентрацией ионов водорода 1 моль/л. Через сосуд пропускают газообразный водород под давлением 1 атм (≈105 Па) при температуре 298К. Часть поглощенного платиной водорода переходит в атомарное состояние, поэтому в поверхностном слое пластины устанавливается равновесие: ½(Н2) {Н+} + ē Схематически водородный электрод изображают следующим образом: Рt, Н2 / Н+ Потенциал водородного электрода при стандартных условиях (СН+ = 1 моль/л; РН2 = 1атм; Т = 298К) принят равным нулю: ЕºН+/Н2 = 0. Электродные потенциалы металлов, измеренные по отношению к стандартному водородному при стандартных условиях (С Меn+= 1моль/л; Т = 298К) называют стандартным и обозначают ЕºMen+/Me. Величиной стандартного электродного или окислительно-восстановительного потенциала, измеренного по отношению к стандартному водородному электроду, можно характеризовать равновесие между любой окисленной и восстановленной формой при концентрации всех форм, участвующих в электродном равновесии, равной 1 моль/л и температуре 298К. Значения Еº для окислительно-восстановительных систем можно найти в справочниках, эти значения находятся в диапазоне от –3 до ≈+3В. Минимальное значение (-3,0 В) отвечает электродному равновесию Li+ + ē = Li, максимальное значение +2,87В характеризует электрохимическую систему F2 + 2ē = 2F-. Чем ниже значение Еº, тем более выражены восстановительные свойства восстановленных форм соответствующих окислительно-восстановительных систем. И наоборот, чем выше значение Еº, тем более выражены окислительные свойства окисленных форм соответствующих окислительно-восстановительных систем. Самым сильным восстановителем в водном растворе является Li, самым сильным окислителем F2. Сильные восстановители сопряжены в паре со слабыми окислителями (Li+), сильные окислители сопряжены в паре со слабыми восстановителями (F-). Условно можно принимать, что хорошим окислителям соответствуют потенциалы ≈ 1 – 0,5В. Значения окислительно-восстановительных потенциалов Е процессов, протекающих в условиях, отличных от стандартных, зависят от концентраций окисленной и восстановленной форм, от температуры и определяются по уравнению Нернста: RT ПСν (ок.ф.) Е = Еº + ----- ln --------------- , nF ПСκ (восст.ф.) где Е – потенциал системы при условиях, отличных от стандартных; Еº - стандартный окислительно-восстановительный потенциал окислительно-восстановительного процесса; R – универсальная газовая постоянная, равная 8,314 Дж/(моль·К); Т – температура, К; F – число Фарадея, равное ≈96500 Кл/моль; n – число молей эквивалентов электронов, участвующих в электрохимической реакции; ПСν (ок.ф.), ПСκ (восст.ф.) – произведение концентраций окисленной и восстановленной форм; ν, κ - их стехиометрические коэффициенты. Если в уравнение Нернста подставить значения постоянных F, R, перейти к десятичному логарифму, Т = 298К, получим: Е = Еº + Например, для системы Co3+ + ē = Co2+ Е = 1,84 + Для системы Cu2+ + 2ē = Cu Е = 0,34 + ПРИМЕР1. Рассчитать потенциал серебряного электрода, помещенного в 0,1М раствор нитрата серебра, при Т = 298К. РЕШЕНИЕ. AgNO3 является сильным электролитом: AgNO3 → Ag+ + NO3-. C(Ag+) = Co·α·n = 0,1·1 1 = 0,1 (моль/л). В 0,1М растворе AgNO3 концентрация ионов Ag+ = 0,1 моль/л. Е = 0,8 + ПРИМЕР 2. Магниевую пластинку опустили в раствор соли, при этом электродный потенциал Е(Mg2+/Mg) оказался равным –2,41В. Вычислить концентрацию (моль/л) ионов магния в растворе. РЕШЕНИЕ. Поскольку Е(Mg2+/Mg) = Еº(Mg2+/Mg) + 0,059/2 lgC(Mg2+), [Е(Mg2+/Mg) - Еº(Mg2+/Mg)] = (-2,41+2,37) =· C (Mg2+) = 0,044 моль/л. ПРИМЕР 3. Вычислить потенциал водородного электрода в 0,1М растворе H2SO4. РЕШЕНИЕ. H2SO4 является сильным электролитом: H2SO4 → 2H+ + SO42-. C(H+) = Co·α·n = 0,1 1 2 = 0,2 (моль/л). Подставляем C(H+) в уравнение Нернста: Е (H+/H2) = 0 + Используя значения стандартных электродных потенциалов, можно определить возможность и глубину протекания окислительно-восстановительных реакций. Чем более отрицательным является значение Еº, тем лучшим восстановителем является вещество и наоборот, чем более положительное значение Еº, тем лучшим окислителем является вещество. Например, из двух веществ – цинка и H2SO3 – более сильным восстановителем является Zn: Zn2+ + 2ē = Zn; Еº = -0,76B; SO42- + 4H+ + 2ē = H2SO3 + H2O; Еº = 0,17B. Сопоставляя окислительные способности оксида марганца(IV) и перманганат-иона в кислой среде, можно сделать вывод, что ион MnO4- является более сильным окислителем, так как для соответствующего окислительно-восстановительного процесса значение Еº более положительно: MnO2 + 4H+ + 2ē = Mn2+ + 2H2O; Еº = 1,23B; MnO4- + 8H+ + 5ē = Mn2+ + 4H2O; Еº = 1,51B. Самопроизвольно протекающие реакции характеризуются отрицательной величиной изменения энергии Гиббса (∆Gº298). Величина ∆Gº298 для окислительно-восстановительных реаккций связана с разностью потенциалов двух окислительно-восстановительных пар уравнением: ∆Gº298 = -n·F·∆Eº298 (2), где n – число молей эквивалентов электронов, участвующих в электрохимической реакции; F – число Фарадея; ∆Eº298 = Eºокислителя - Eºвосстановителя. Поскольку термодинамически возможны процессы, для которых ∆Gº298 < 0, то для термодинамически возможных процессов ∆Eº298 > 0. Чем больше значение ∆Eº298, тем более глубоко протекает процесс. ПРИМЕР 4. Определить направление окислительно-восстановительной реакции: K2Cr2O7 + 6KI + 7 H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O. Определить также ∆Gº298 протекающего процесса. РЕШЕНИЕ. Для определения возможности осуществления ОВР необходимо сравнить окислительно-восстановительные потенциалы Eº соответствующих полуреакций окисления и восстановления: Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O; Еº = 1,33B; I2 + 2ē = 2I-; Еº = 0,54B. Значения Eº показывают, что ион Cr2O72- является более сильным окислителем, чем I2. Следовательно, реакция будет протекать в прямом направлении. ∆Eº298 = Eºокисл. - Eºвосст. = 1,33 – 0,54 = 0,79(В). ∆Gº298 = -nF∆Eº298 = -6·96500·0,79 = -457410Дж = -457,41кДж. Величина ∆Gº298 связана с константой химического равновесия соотношением: ∆Gº298 = -R·T·lnKc или при 298К ∆Gº298 = -R·298·lnKc,298 (3). Приравнивая правые части уравнений (2) и (3), получим: -n·F·∆Eº298 = -R·298·lnKc,298. Отсюда lgKс =
ПРИМЕР 5. Для окислительно-восстановительной реакции KMnO4 + Al + H2SO4 →… определить ∆Gº298 и значение константы Кс при 298К. РЕШЕНИЕ. Запишем уравнение реакции: 6KMnO4 + 10Al + 24H2SO4 = 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O. Полуреакции окисления, восстановления и их значения Eº: MnO4- + 8H+ + 5ē = Mn2+ + 4H2O; Еº = 1,51B; Al - 3ē = Al3+; Еº = -1,66B. ∆Eº298 = 1,51 – (-1,66) = 3,17(B). ∆Gº298 = -nF∆Eº298 = -15·96500·3,17 = -4588575Дж = -4588,6кДж. n·∆Eº/0,059 Кс = 10 = 1015· 3,17/0,059 = 8,55·10805. Значение Кс очень велико, что свидетельствует о практической необратимости прямой реакции.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ Гальваническим элементом называется электрохимическая система, производящая электрическую энергию за счет протекания в ней окислительно-восстановительной реакции. Наиболее распространенными являются гальванические элементы, состоящие из двух электродов с различными потенциалами. Рассмотрим реакцию: Zn + CuSO4 = ZnSO4 + Cu Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn, Fe, Cu, Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается. Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции: Zn – 2e = Zn2+ Cu2+ + 2e = Cu Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
Рисунок 1 – Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби) Сосуд А заполнен раствором ZnSO4, сосуд Б – раствором CuSO4. В первый из них опущена цинковая пластинка, во второй – медная. Растворы либо разделены пористой полупроницаемой перегородкой (пропускает только ионы), либо соединяются солевым мостиком B, который представляет собой стеклянную трубку, заполненную раствором сильного электролита (обычно KCl или NH4NO3). Если соединить обе пластинки проводом, то по нему в указанном стрелкой направлении начнут перемещаться электроны (потечет электрический ток). Трубка В обеспечивает замкнутость цепи, по ней перемещаются ионы SO42–. Электрод, на котором происходит процесс восстановления (на рисунке 1 – медный) называется катодом, а электрод, на котором осуществляется окисление (в рассмотренном примере – цинковый) – анодом. В электротехнике принята противоположная система обозначений электродов: катодом называют отрицательный полюс источника тока, т.е. электрод, передающий электроны во внешнюю цепь (в данном случае цинковый). В данном случае электродные процессы являются гетерогенными, т.к. окисленная и восстановленная формы находятся в разных фазах. В более общем виде гетерогенный электродный процесс можно записать в виде: Me (ВФ, тв. фаза) – ne– Гальванические элементы принято изображать в виде схемы, в которой указывается электрод и электролит, а вертикальные линии показывают границы раздела. Одна вертикальная черта символизирует границу раздела между металлом и электролитом, двойная вертикальная черта – границу раздела между электролитами: Анод─ Zn|ZnSO4||CuSO4|Cu +Kатод . В ионной форме схематическое изображение гальванического элемента: Анод─ Zn|Zn2+||Cu2+|Cu +Kатод . На границе раздела фаз возникает двойной электрический слой, состоящий из катионов Men+ (в растворе) и электронов (в металле), что приводит к появлению потенциала E(Men+/Me). Его абсолютная величина определению не поддается, однако легко измеряется разность потенциалов катода и анода, которая называется электродвижущей силой (ЭДС) гальванического элемента ∆E=Eк–Eа. Поскольку самопроизвольно электроны могут переходить только от электрода с большей концентрацией электронов к электроду с меньшей концентрацией, то в процессе действия рассматриваемого гальванического элемента электроны во внешней цепи движутся от цинка к меди. На цинковом электроде происходит процесс окисления, так как значение стандартного электродного потенциала Еº(Zn2+/Zn) = -0,76B меньше Еº(Cu2+/Cu) = 0,34B. ∆Eº = Eº(Cu2+/Cu) - Eº(Zn2+/Zn) = 0,34 –(-0,76) = 1,1(В). Медь в данном процессе играет роль инертного электрода, который передает электроны, поступившие от цинка, ионам Cu2+, находящимся в растворе CuSO4.Таким образом, на медном электроде происходит восстановление катионов меди. Указанные окислительно-восстановительные процесы отображены в схеме гальванического элемента. Во внутренней цепи ионы SO42-, оказавшиеся в избытке в катодном пространстве, переходят через пористую перегородку или через солевой мостик в анодное пространство, где компенсируют заряды образовавшихся при окислении ионов цинка. Элемент будет работать до тех пор, пока цинковый анод полностью не растворится или не восстановится вся медь из раствора CuSO4. При описании работы гальванического элемента выделяют процессы, происходящие на электродах, и суммарную окислительно-восстановительную реакцию, указывают направление движения электронов во внешней цепи и ионов в растворе электролита. Для медно-цинкового гальванического элемента: Zn ‑ 2ē = Zn2 + - процесс окисления на аноде; Cu2+ + 2ē = Cu – процесс восстановления на катоде; Zn + Cu 2+= Zn2+ + Cu – суммарная реакция в гальваническом элементе. Направление движения электронов – от цинкового электрода к медному. Ионы SO42- перемещаются из сосуда медного электрода в сосуд цинкового. Если гальванический элемент находится в условиях, отличных от стандартных, то для расчета ЭДС сначала необходимо найти значения потенциалов электродов в данных условиях по уравнению Нернста, а затем вычислять ЭДС элемента. Поскольку электродвижущая сила гальванического элемента всегда положительная величина, при ее определении вычитают из величины более положительного потенциала величину менее положительного: ПРИМЕР 1. Вычислить ЭДС гальванического элемента, составленного из стандартных цинкового и оловянного электродов, опущенных в растворы сульфатов цинка и олова. РЕШЕНИЕ. Запишем уравнения электродных равновесий, устанавливающихся на цинковом и оловянном электродах, и выпишем из таблицы значения их стандартных электродных потенциалов: Zn2+ + 2ē = Zn; Еº = -0,76B; Sn2+ + 2ē = Sn; Еº = -0,14B. Электродный потенциал цинкового электрода имеет более низкое значение, следовательно, цинковый электрод будет анодом, на нем будет происходить процесс окисления. На оловянном электроде с бóльшим значением Еº будет происходить восстановление: Zn - 2ē = Zn2+ -процесс на аноде; Sn2+ + 2ē = Sn - процесс на катоде; Zn + Sn2+ = Zn2+ + Sn – суммарная реакция в гальваническом элементе. Электроны по внешней цепи переходят от цинка к олову. Ионы SO42- будут переходить по солевому мостику из катодного пространства в анодное. ЭДС = E(Sn2+/Sn) - Е(Zn2+/Zn) = -0,14 – (-0,76) = 0,62(В). ПРИМЕР 2. Гальванический элемент образован электродом Fe2+/Fe с концентрацией ионов Fe2+ = 0,1 моль/л и серебряным электродом Ag+/Ag с концентрацией ионов Ag+ = 0,01 моль/л. Написать уравнения электродных процессов, составить схему гальванического элемента, вычислить его ЭДС. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 +6K2SO4+8H2O
Fe
+6K2SO4+8H2O
Fe  O3 + 3H
O3 + 3H 
 2KCl–1 + O
2KCl–1 + O  2NaN+3O2+ O
2NaN+3O2+ O  + O
+ O 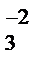 + S+4O
+ S+4O 
 4 (процесс окисления)
4 (процесс окисления) , SO
, SO  , SO
, SO  . Слабые электролиты, малорастворимые соли и газообразные вещества в таких уравнениях записывают в виде молекул, сильные электролиты – в виде ионов.
. Слабые электролиты, малорастворимые соли и газообразные вещества в таких уравнениях записывают в виде молекул, сильные электролиты – в виде ионов.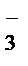 +4H+®NO+2Н2О
NO
+4H+®NO+2Н2О
NO  +Н2О®NO
+Н2О®NO  +2Н2О®MnO2 + + 4ОН–
S+8ОН–® SO
+2Н2О®MnO2 + + 4ОН–
S+8ОН–® SO  +4Н2О
+4Н2О

 в кислой среде, в щелочной среде он преобразуется в ион CrО
в кислой среде, в щелочной среде он преобразуется в ион CrО  , Cr(OH)3 в зависимости от концентрации щелочи.
, Cr(OH)3 в зависимости от концентрации щелочи. O7
O7
 O N
O N 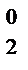 N–3H3 (NH4NO3)
N–3H3 (NH4NO3) NO
NO  NO
NO SO
SO  S.
S. Cu или в общем виде Men++ nē
Cu или в общем виде Men++ nē 
 lg
lg  .
. lg
lg  -
-  --- .
--- . lg С(Cu2+).
lg С(Cu2+). или Кс =
или Кс =  .
.