
|
|
Химические свойства кислот1. Взаимодействие с оксидами металлов с образованием соли и воды:
2. Взаимодействие с амфотерными оксидами с образованием соли и воды:
3. Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
4. Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
5. Взаимодействие с солями, если выпадает осадок или выделяется газ:
6. Сильные кислоты вытесняют более слабые из их солей:
(в данном случае образуется непрочная угольная кислота 7. Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе.
Получение кислот 1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот): SO3 + H2O = H2SO4 P2O5 + 3H2O = 2H3PO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот): H2 + Cl2 = 2HCl H2 + S = H2S 3. Реакциями обмена соли с кислотой (вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами): Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3, Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl 2NaCl(тв.) + H2SO4(конц.)═ Na2SO4 + 2HCl По способности вытеснить друг друга из солей кислоты можно расположить в ряд, в котором предшествующие кислоты вытесняют последующие: H2SO4 Уменьшение силы кислоты
СОЛИ Солями называются соединения, состоящие из атомов металла и кислотного остатка. Соли можно рассматривать как продукты реакции нейтрализации, в которой атомы водорода кислоты и гидроксогруппы основания соединяются, образуя воду, а атомы металла и кислотный остаток образуют соль: Ba(OH)2 + H2SO4 ® BaSO4 + 2H2O.
Классификация солей:
Средние - соли, полученные в результате полного замещения атомов водорода в кислоте на атомы металла, например в реакции нейтрализации: 3Mg(OH)2 + 2H3PO4 ® Mg3(PO4)2 + 6H2O. При диссоциации дают только катионы металла (или NH4+) Na2SO4 = 2Na+ +SO42- CaCl2 = Ca2+ + 2Cl-
Кислые соли - продукты неполного замещения атомов водорода многоосновной кислоты на атомы металла. Кислые соли могут образовывать двух и более основные кислоты, как кислородсодержащие, так и бескислородные кислоты. Гидрогруппа принадлежит аниону: Mg(OH)2 + H3PO4 ® MgНPO4 + 2H2O. . При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка. NaHCO3 = Na+ + HCO3- = Na+ + H+ + CO32- . Основные соли - продукты неполного замещения групп OH соответствующего основания на кислотные остатки: Fe(OH)3 + HCl ® Fe(ОН)2Cl + H2O. Основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп. Гидроксогруппа принадлежит аниону. При диссоциации дают катионы металла, анионы гидроксида и кислотного остатка. Zn(OH)Cl = [Zn(OH)]+ + Cl- = Zn2+ + OH- + Cl-
Двойные. При диссоциации дают два катиона и один анион. KAl(SO4)2 = K+ + Al3+ + 2SO42-
Смешанные. Образованы одним катионом и двумя анионами: CaOCl2 = Ca2+ + Cl- + OCl-
Комплексные. Содержат сложные катионы или анионы: [Ag(NH3)2]Br, Na[Ag(CN)2] Название средней соли по международной номенклатуре состоит из латинского названия кислотного остатка и названия металла в родительном падеже, причем для металлов, проявляющих разные степени окисления, указывают степень окисления. При этом следует помнить, что кислотные остатки кислородсодержащих кислот содержат суффикс «-ат», если образующий кислоту элемент имеет высшую степень окисления, и «-ит» – в случае более низкой степени окисления элемента, например: Zn(N+5O3)2 – нитрат цинка, Zn(N+3O2)2 – нитрит цинка. Приставка «пер-» указывает на самую высокую степень окисления элемента, приставка «гипо-» указывает на его самую низкую положительную степень окисления. Систему названий кислотных остатков можно показать на примере названий солей элементов VII группы: KCl+7O4 – перхлорат; KMn+7O4 – перманганат; KCl+5O3 – хлорат; K2Mn+6O4 – манганат; KCl+3O2 – хлорит; K2MnO3 – манганит; KCl+1O – гипохлорит. Приставки «мета-», «орто-», «ди-», «три-» и т. д. переходят в название кислотного остатка из названия кислоты: NaBO2 – метаборат натрия, Na4P2O7 – дифосфат натрия. Кислотные остатки бескислородных кислот имеют суффикс «-ид»: AgBr – бромидсеребра, CaCl2 – хлорид кальция. Названия кислых солей составляют, добавляя к названию кислотного остатка приставки «гидро-», «дигидро-» и т. д., которая отражает число незамещенных на металл атомов водорода: NaHSO3 – гидросульфит натрия, NaH2PO4 – дигидрофосфат натрия. Названия основных солей содержат приставку «гидроксо-», «дигидроксо-» и т. д. перед названием металла, которая отражает число незамещенных на кислотный остаток гидроксогрупп: AlOHSO4 – сульфат гидроксоалюминия, [Fe(OH)2]2SO4 – сульфат дигидроксожелеза (III).
Средние соли Получение Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами: 1) Металла с неметаллом: 2Na + Cl2 = 2NaCl
2) Металла с кислотой: Zn + 2HCl = ZnCl2 + H2

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

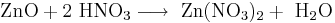




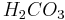 , которая сразу же распадается на воду и углекислый газ)
, которая сразу же распадается на воду и углекислый газ) любой концентрации и концентрированной серной кислоты
любой концентрации и концентрированной серной кислоты  ), если образующаяся соль растворима:
), если образующаяся соль растворима:
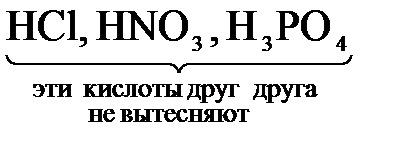 HNO2 CH3COOH Н2СО3 H2SiO3
HNO2 CH3COOH Н2СО3 H2SiO3