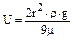|
|
Задачи к первому учебному модулюЗадача № 1. Среднее время пребывания SO2 в атмосфере составляет 3-7 суток, оцените скорость его поступления в атмосферу, если средняя концентрация SO2 в тропосфере 0,05 мкг/м3. В оценках принять: высота тропосферы 11 км, радиус Земли – 6400 км. Задача № 2. Среднее время пребывания оксидов азота в тропосфере равно 4 суткам. Оцените содержание оксидов азота в тропосфере, если суммарная скорость эмиссии из антропогенных источников составляет по экспериментальным оценкам 110 млн т/год. Задача № 3. Оцените время жизни NH3 в тропосфере по отношению к процессам трансформации и выведения, если общее содержание в тропосфере 1 млн . т, а скорость поступления в тропосферу – 70 млн т/год. Задача № 4. Рассчитайте концентрацию атомов Ar на высоте 25 км. (Доля атомов Ar в приземном слое воздуха равна 1%, kб = 1,38 . 10–23 Дж/К). Задача № 5. На какой высоте концентрация молекул азота уменьшится в n раз по сравнению с концентрацией в приземном слое воздуха? Задача № 6. Оцените, во сколько раз частота дыхания на высоте над уровнем моря в 8000 м должна быть больше по сравнению с нулевой отметкой над уровнем моря, чтобы исключить кислородное голодание. Задача № 7. Рассчитайте, во сколько раз давление в приземном слое воздуха больше, чем на высоте 10 км. Задача № 8. Оцените минимальную концентрацию молекул О3 в озоновом слое, необходимую для ослабления потока УФ-излучения Солнца в 1000 раз. Сечение фотопоглощения на длине волны 254 нм равно 7,8 . 10–18 см2, а средняя толщина озонового слоя, приведенная к нормальным условиям, составляет 2,5 мм. Задача № 9. Вычислите скорость фотодиссоциации молекул О2 на высоте 50 км в континууме Герцберга, если константа скорости фотодиссоциации равна 1,5 . 109 с–1. Задача № 10. Определите скорость реакции О(1D) + О2 ® О(3Р) + О2 на высоте 30 км, если константа скорости процесса равна 7 . 10–17 м3/с, а концентрация атомов О(1D) составляет около 1015 частиц/м3. Задача № 11. Константы скорости взаимодействия молекулы озона и радикала ОН· с углеводородами терпенового ряда (С10Н16) составляют 10–17 см3/с и 5 . 10–11 см3/с, соответственно. Оцените вклад каждого канала в разложение углеводородов, если средняя концентрация последних на высоте 10 км составляет 0,001 мкг/м3, а концентрация радикалов ОН· и молекул О3 равны, соответственно, 106 и 2,5 . 1012 частиц/см3. Задача № 12. В вентиляционных выбросах содержится аэрозоль серной кислоты со средним диаметром частиц 20 мкм/плотности воздуха и аэрозоля серной кислоты составляет, соответственно, 1,29 и 4,78 кг/м3, вязкость воздуха – 18,26 . 10–6 кг/с . м 2. Долетают ли частицы аэрозоля до крыши близлежащего здания, если расстояние до него 50 м, разность высот источника выбора и крыши здания – 50 м, скорость ветра – 3 м/с. Задача № 13. Рассчитайте концентрацию NO и NO2 в стратосфере, если их взаимную природную трансформацию ограничить следующими реакциями: М + NO + O· ® NO2 + M NO2 + O· ® NO + O2 [M] = 1013 частиц/см3, к1 = 8 . 10–32 см6/с, к2 = 10–12 см3/с Задача № 14. Если размер частицы больше величины среднего свободного пробега молекулы газа, то скорость ее осаждения описывается уравнением Стокса:
где r и r – радиус и плотность частицы; m – динамическая вязкость воздуха (1,81 . 10–4 Пуаз при 200С); g – ускорение свободного падения. Оцените верхний предел скорости осаждения сферических частиц аэрозоля радиусом 20 мкм в нижней тропосфере и на высотах стратопаузы. Задача № 15. Скорость образования озона в верхних слоях атмосферы под действием космических лучей составляет 10 млн. мол. О3/(см3 . с) в слое толщиной 10 км от поверхности Земли. Концентрация озона в этом слое составляет 5 . 1017 мол. О3/см3. Можно ли объяснить образование озонового слоя радиационно-химическими реакциями, инициируемыми космическими лучами? Задача № 16. Пользуясь данными таблицы 1, рассчитайте концентрацию паров H2SO4 в приземном слое воздуха и рН осадков на расстоянии 100 км от источника выброса, если концентрация SO2 в источнике выброса равна 5 мг/м3. В расчетах принять скорость ветра – 9 м/с. Таблица 1. Значения коэффициентов скорости трансформации
Задача № 17. Оцените распределение SO2 и H2SO4 в приземном слое воздуха по мере удаления от источника выброса при постоянной скорости ветра 10 м/с, если концентрация SO2 в устье источника выброса равна 2 мг/м3 (таблица 1). Задача № 18. Оцените концентрации NO2 и HNO3 в зависимости от расстояния от источника выброса, если содержание NO2 в устье источника выброса равно 0,5 мг/м3, скорость ветра постоянна и равна 5 м/с (таблица 1). Задача № 19. Оцените время полувыведения в процессе коагуляции аэрозольных частиц радиусом (r) 0,3 мкм. В оценках принять: среднюю длину свободного пробега l = 90 нм, концентрацию частиц n = 1011 м–3. k = 1,38 . 10–23 Дж/К, вязкость среды m = 18,27 . 10 кг/м2 . с. Задача № 20. При отсутствии возмущений концентрация О3 в стратосфере в полярных областях максимальна по сравнению со средними и тропическими широтами, и составляет 4¸5 . 1012 см–3. Оцените, во сколько раз происходит ослабление потока УФ-квантов света на длине волны l = 254 нм (сечение фотопоглощения на данной длине волны озоном имеет величину 7,8 . 10–18 см2), если толщина слоя озона, приведенная к нормальным условиям, составляет около 4 мм. Задача № 21. Наиболее сильный эффект истощения озонового слоя наблюдался весной 1987 года, когда в отдельных областях антарктической атмосферы общее количество озона падало до 100 единиц Добсона (е.Д.). Во сколько раз произошло уменьшение общего содержания О3 в атмосфере в этот год? Задача № 22. Рассчитайте эффективную температуру приземного слоя воздуха без учета влияния атмосферы. В расчетах принять: интенсивность солнечного излучения на верхней границе атмосферы 1400 Дж/м2 . с, средняя величина альбедо земной поверхности 0,33, константа Стефана – Больцмана 5,67 . 10–8 Вт/(м2 . К4). Найденное значение сравните со средней наблюдаемой температурой земной поверхности и объясните различие в величинах. Задача № 23. По содержанию основных компонентов стратосфера полностью гомогенна, но на высоте 25-30 км она содержит незначительное по абсолютной величине количество озона (объемная доля около 10 млн–1). Благодаря значительному сечению поглощения в УФ-области спектра, а максимум сечения поглощения приходится на 255 км и составляет 8 . 10–18 см2, озоновый слой практически полностью поглощает излучение в области длин волн УФ-излучения солнца в максимуме сечения поглощения озоновым слоем Земли. Задача № 24. Среднее содержание О3 в стратосфере на высотах 25-30 км составляет 10 млн–1, а в тропосфере – в среднем около 0,04 млн–1. Опишите механизмы образования озона на разных высотах: в тропосфере и стратосфере, функции озона в разных слоях атмосферы. Укажите источники и стоки озона в атмосфере и стратосфере. Задача № 25. Стратосферный озон ослабляет поток УФ-излучения солнца в невозмущенных условиях примерно в 6650 раз. Сечение фотопоглощения озона в максимуме (на длине волны 254 нм) составляет 7,8 . 10–18 см2. Рассчитайте концентрацию озона и толщину озонового слоя, необходимую для ослабления УФ-излучения солнца в указанное число раз. Задача № 26. В таблице 2 приведены значения коэффициентов Генри (КГ) для некоторых газов при 25оС. Пользуясь данными таблицы, перечислите соединения, которые будут находиться в атмосфере преимущественно в растворенной форме (обоснуйте выбор соответствующими реакциями). Таблица 2. Значения коэффициентов Генри (КГ) для некоторых газов при 25оС
Задача № 27. Известно, что сродство гемоглобина к СО (эффективность связывания СО гемоглобином) примерно в 300 раз больше, чем сродство к кислороду. Рассчитайте максимально допустимое содержание СО в приземном слое воздуха, чтобы исключить отравление организма. Найденное значение сравните с нормируемым (ПДК = 3 мг/м3). Задача № 28. Ниже приведены признаки отравления при различном содержании комплекса гемоглобина с СО (Hb . СО). Оцените, что произойдет с Вами, если Вы находитесь в производственном помещении, где концентрация СО составляет 40 мг/м3.
Задача № 29. Среднее время пребывания SO2 в атмосфере составляет 5 суток. Оцените скорость его поступления в атмосферу, если средняя концентрация SO2 в тропосфере 0,05 мкг/м3 (принять, что высота тропосферы 11 км, радиус Земли – 6400 км). Задача № 30. Рассчитайте, во сколько раз давление в приземном слое воздуха больше, чем на высоте 10 км. Задача № 31. Рассчитайте толщину озонового слоя, необходимую для ослабления потока УФ-излучения солнца в 6600 раз, если сечение фотопоглощения на длине волны 254 км равно 7,8 . 10–18 см2, а средняя концентрация О3 в озоновом слое примерно 10 млн–1. Задача № 32. Рассчитайте эффективную приземную температуру приземного слоя воздуха без учета влияния атмосферы. в расчетах принять: интенсивность солнечного излучения на верхней границе атмосферы 1400 Дж/м2 . с, средняя величина альбедо земной поверхности 0,33, константа Стефана – Больцмана 5,67 . 10–8 Вт/(м2 . К4). Задача № 33. Пользуясь данными таблицы 1(модуль 1), рассчитайте концентрацию паров H2SO4 приземном слое воздуха на расстоянии 100 км от источника выброса, если концентрация SO2 в устье источника выброса равна 5 мг/м3, а средняя скорость ветра – 9 м/с.
ОТВЕТЫ НА ЗАДАЧИ для самостоятельного решения
1. Значение ПДК превышается в 14 раз для уксусной кислоты и в 88 раз для аммиака. Парциальное давление уксусной кислоты составит 0,1 Па. В каждом см3 будет 1,25 . 1015 молекул аммиака; 2. Роса выпадет; 3. 37 . 1017 кг; 4. 10,9 . 104 т/год; 5. В 3,6 раза; 6. 23 . 1010 т; 7. 131 день; 8. 1,9 км/с; 9. Нет. Среднеквадратичная скорость движения молекул и атомов будет ниже второй космической скорости; 10.0,63%; 11.8,33% (об.); 2,0 . 1018см-3; 8,33 . 104 млн–1; 12.128 нм; 13.а) ~ 30 лет, б) 140 с; 14.1,6 . 1015см-3; 89 мг/м3; 667 млн–1; 6,8 Па; 15.1,5 . 1014см–3; 11,9 мг/м3; 6,4 млн-1; 0,60 Па; 16.3,4 . 1015см–3; 13 Па; в 4670 раз больше ПДК; 17.140 млн–1; 3,8 . 1015 см'3; 192 мг/м3; 16,0 Па; 18.V1/V2 = 1,42; 19.0,034; 20.Да, превышается; 21.V1/V2 = 0,4; T1= 104 с; Т2= 4 . 103 с; 22.2,45 . 10–3; 65,4 мг/м3; 23.13,3; 24.9,8 . 103; 25.C2HF3Cl2, CFC13; Ф-11 более опасен; 26.Ф-141, Ф-123; 27.При уменьшении альбедо температура возрастет на 6 градусов, при увеличении альбедо температура снизится на 6,5 градусов.
ПРИЛОЖЕНИЕ Таблица 1.Важнейшие физические константы
Таблица 2.Равновесные парциальные давления паров воды в воздухе при различных температурах
Таблица 3. Константы Генри (КГ) для некоторых газов при температуре 298 К
ЛИТЕРАТУРА
1. Андруз Дж., Бримблекумб П., Джикелз Т., Лисс П. Введение в химию окружающей среды. Пер. с англ. – М.: Мир, 1999. – 271 с. 2. Исидоров В.А. Экологическая химия: Учебное пособие для вузов. – СПб.: Химиздат, 2001. – 304 с. 3. Гусакова Н.В. Химия окружающей среды. Серия «Высшее образование». – Ростов-на-Дону: Феникс, . – 192 с. 4. Исидоров В.А. Введение в химическую экотоксикологию: Учебное пособие для вузов. – СПб.: Химиздат, 1999. – 144 с. 5. Бримблекумб П. Состав и химия атмосферы. Пер с англ. – М: Мир, 1988. – 351 с. 6. Тарасова Н.П. Дисперсные системы в атмосфере. – М.: Изд-во Хронес совместно с ВЦ РХТУ, 1994. – 86 с. 7. Экологическая химия. Под ред. Ф. Корте. Пер. с англ. – 2004. – 396 с. 8. Человек и его среда обитания. Под ред. Г.В. Лисичкина и Н.Н. Чернова. – 2004. – 460 с. 9. Хенсе М., Харренмойс П., Янсен Е., Арвин Э. Очистка сточных вод. Под ред. Л. Дернера. Пер. с англ. – 2004. – 400 с.
СОДЕРЖАНИЕ
Учебное издание
Татьяна Геннадьевна Дмитриенко
Физико-химические процессы в атмосфере
Учебное пособие
Редактор В.В. Макаров ____________________________________________________________________________
Подписано к печати 19.12. 2005 г. Формат 60 х 84 1/16. Усл. печ. л. 6,5.Уч.-изд. л. 6.2. Бесплатно. Зак. № ____________________________________________________________________________ Типография СВИРХБЗ

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|