|
|
Трансформация соединений серы в тропосфере
Основные поступления неорганических соединений серы в тропосферу связаны с антропогенными источниками. На их долю приходится примерно 65% всех поступлений неорганических соединений серы в атмосферу. Около 95% из этого количества составляет диоксид серы. Из природных источников поступления неорганических соединений серы следует выделить волновую деятельность в океанах, приводящую к образованию аэрозолей. Общее количество серы, содержащейся в аэрозолях в виде сульфатов магния и кальция, оценивается в 44 млн т в год, что составляет примерно 30% от ее поступления в атмосферу в виде неорганических соединений. Биологические источники неорганических соединений серы выделяют преимущественно сероводород, с которым в атмосферу поступает по различным оценкам от 23 до 49% всех неорганических соединений серы. Масштабы поступления сероводорода в атмосферу и процессы его трансформации в атмосфере изучены еще недостаточно подробно. Имеющиеся в литературе сведения позволяют лишь грубо оценить его содержание в тропосфере. Так, над океанами концентрация Н2S колеблется от 0,0076 до 0,076 мкг . м –3, а над континентами – от 0,05 до 0,1 мкг × м –3. Принимая во внимание скорость поступления сероводорода в атмосферу и его содержание в тропосфере, можно оценить время его жизни в атмосфере в несколько часов. Как уже отмечалось выше, в тропосфере происходят процессы окисления соединений серы, основным окислителем в которых выступают свободные радикалы. Сероводород, например, последовательно, в ряде стадий окисляется до SO2. Детальный механизм этого процесса еще не установлен. Наиболее вероятным представляется протекание следующих реакций: Н2S + ОН· ®H2O + HS· (94) НS· + О2 ® SO· + OH· (95) SО + НO2 ® SO2 + OH· (96) Полученный в результате диоксид серы, как и SO2, поступающий из других источников, окисляется далее. Механизм этого процесса изучен более подробно. Окисление диоксида серы может протекать в газовой фазе – первый путь, в твердой фазе (окислению предшествует адсорбция) – второй путь и в жидкой фазе (окислению предшествует абсорбция) – третий путь. Газофазное окисление (первый путь) исторически является первой попыткой объяснить процессы окисления диоксида серы в атмосфере. Долгие годы основной механизм процесса связывали с образованием диоксида серы в возбужденном состоянии, который, реагируя с молекулярным кислородом, образует SO3: SO2 + hn ® SO2*, 290 нм < l < 400нм (97) SO2* + 2O2 ® SO3 + O3 (98) или с реакцией с участием третьего тела: SO2* + O2 + M ® SO4 + М* (99) SO4 + O2 ® SO3 + О3 (100) Образующийся SОз вступает во взаимодействие с молекулой воды: SО3 + Н2О ® Н2SО4 (101) Однако, как показали исследования последних десятилетий, рассмотренный механизм является возможным, но никак не основным процессом окисления SО2 в газовой фазе. Лабораторные эксперименты показали, что скорость изменения концентрации SO2 в фотохимических камерах, содержащих очищенный воздух, описывается кинетическим уравнением первого порядка. Значение константы скорости процесса составляет 10 –3 . ч –1. Квантовый выход реакции изменяется от 10 –3 до 5 . 10 –3. Процесс окисления SO2 в фотохимических камерах значительно ускоряется, если в воздухе содержатся оксиды азота или углеводороды. В этом случае становится возможным протекание процессов с участием атомарного кислорода и свободных радикалов. Атомарный кислород окисляет молекулу SO2 при участии третьего тела: SO2 + O + M®SO3 + M* (102) Принимая во внимание экспериментально найденное значение константы скорости этого процесса и концентрации атомарного кислорода и третьего тела в атмосфере, можно утверждать, что этот процесс следует учитывать только на высоте более 10 км при концентрации SО2, равной 1 мкг . м –3. Время пребывания диоксида серы на высоте 10 км при отсутствии других процессов должно составлять примерно 1000 ч и должно уменьшаться на высоте 30 км до 5-10 ч. Из того, что время жизни диоксида серы в приземном слое воздуха значительно отличается от расчетных значений – по реакции (102), следует, что реакция окисления SO2 атомарным кислородом не играет существенной роли в трансформации соединений серы в тропосфере; ведущую роль играют свободные радикалы. Протекающие при этом процессы можно представить следующими уравнениями реакций: SО2 + ОН + М ® НSО3 + М* (103) НSО3 + НO2 ® SО3 + 2OН (104) SО2 + НO2 ® SО3 + ОН (105) SО2 + СН3О2 ® SО3 + СН3О (106) Скорость трансформации диоксида серы в воздухе, имеющем средние для тропосферы значения концентраций свободных радикалов, составляет примерно 0,1% . ч, что соответствует времени пребывания SО2 в тропосфере, равному 5 суткам. Процесс трансформации диоксида серы резко ускоряется в воздухе промышленных регионов, где увеличивается содержание свободных радикалов. Скорость в этом случае может возрасти до1% . ч–1. Триоксид серы – серный ангидрид – легко взаимодействует с частицами атмосферной влаги и образует растворы серной кислоты (уравнение 1.101), которые, реагируя с аммиаком или ионами металлов, присутствующими в частицах атмосферной влаги, частично переходят в соответствующие сульфаты. В основном это сульфаты аммония, натрия, кальция. Образование сульфатов происходит и в процессе окисления на поверхности твердых частиц, присутствующих в воздухе. В этом случае стадии окисления предшествует адсорбция, часто сопровождающаяся химической реакцией (второй путь окисления диоксида серы): SО2 + СаО ® СаSО3 (107) или SO2 + MgO ® MgSO3 (108) Оксиды железа, алюминия, хрома и других металлов, которые также могут находиться в воздухе, резко ускоряют процесс окисления диоксида серы. Как показали лабораторные эксперименты, в присутствии, например, частиц Fе2О3 скорость процесса трансформации SО2 составляет примерно 100% . ч–1. Необходимо отметить, однако, что данное значение получено для воздуха, в котором содержание оксидов железа в 100-200 раз превышало фоновые концентрации. Поэтому данный процесс трансформации диоксида серы играет основную роль лишь в сильно запыленном воздухе, содержащем значительные количества оксидов металлов. Третий путь окисления диоксида серы в тропосфере связан с предварительной абсорбцией SО2 каплями атмосферной влаги. В дождливую погоду и при высокой влажности атмосферы этот путь окисления может стать основным в процессе трансформации диоксида серы. В качестве окислителя в природных условиях часто выступает пероксид водорода. При высоких значениях рН, когда в растворе в основном находятся ионы SO32-, скорость окисления заметно возрастает. Конечным продуктом окисления, как и в случае окисления в газовой фазе, является серная кислота, которая в дальнейшем может перейти в сульфаты.
 
Рис. 4.Трансформация неорганических соединений серы в тропосфере
– природные поступления соединений серы; – антропогенные поступления соединений серы; – вывод из атмосферы Помимо процессов химической трансформации диоксида серы в серную кислоту и сульфаты сток (вывод из атмосферы) этих соединений происходит в результате процессов мокрого (с атмосферными осадками) и сухого (при контакте с поверхностью почвы, водоема или с растительностью) осаждения. Представленная на рисунке 4 схема наглядно иллюстрирует тропосферную часть цикла неорганических соединений серы. Скорость процессов трансформации и стока диоксида серы, серной кислоты и сульфатов принято представлять в виде кинетических уравнений первого порядка. Скорость соответствующих превращений без учета процессов окисления в твердой фазе можно выразить следующими уравнениями:
где t – время; [SО2], [Н2SО4], [МеSО4] – концентрации диоксида серы, серной кислоты и сульфатов соответственно: k1 и k2, k3 и k4, k5 и k6 – константы скорости процессов мокрого и сухого осаждения диоксида серы, сульфатов и серной кислоты соответственно (рисунок 4); k7 – константа скорости процесса трансформации диоксида серы в серную кислоту (учитывает общую скорость окисления в газовой и жидкой фазах); k8 – константа скорости образования сульфатов из SО2 и Н2SО4. Решения системы уравнений (109-111) позволяет определить долю отдельных компонентов, присутствующих в тропосфере в заданное время после выброса единичного объема диоксида серы в атмосферу. Графическое решение системы уравнений, полученное специалистами Института прикладной геофизики РАН А. В. Лысаком, И. М. Назаровым и А. Г. Рябошапко, представлено на рисунке 5. При решении системы уравнений использовались среднеевропейские значения констант скорости процессов мокрого и сухого осаждения и трансформации соответствующих соединений, равные: k1 = k4 = k6 = k8 = 0,03ч–1; k2 = 0,025ч–1; k3 = k5 = 0,01ч–1;k7= 0,1ч–1.
0 300 600 900 1200 1500
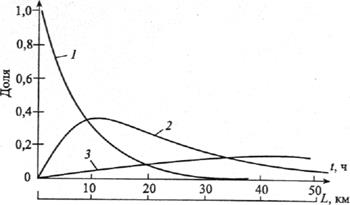
Рис. 5. Зависимость долей серы, представленной в тропосфере в виде диоксида серы, серной кислоты и сульфатов, от времени пребывания в атмосфере t и удаленности от точечного источника выброса L при скорости ветра 30 км/ч: 1 – диоксид серы; 2 – серная кислота; 3– сульфаты
В первый момент после выброса диоксида серы в атмосфере отсутствуют серная кислота и сульфаты. Со временем доля SО3 уменьшается, доля серной кислоты увеличивается, проходит через максимум спустя 10-15 ч после выброса; содержание сульфатов в атмосфере будет постепенно возрастать в течение 40-50 ч, затем медленно начнет снижаться. Полученные результаты наглядно демонстрируют опасность загрязнения атмосферы соединениями серы, связанную с возможностью трансграничного переноса примесей (перенос примесей на большие расстояния). Предположим, например, что над источником выбросов соединений серы дует ветер, имеющий скорость порядка 30 км/ч. В этом случае спустя 10 ч с момента выброса примеси будут удалены на расстояние 300 км от источника выброса. В этом месте доля диоксида серы уменьшится примерно в 5 раз, и основное количество соединений серы будет представлено серной кислотой. В случае выпадения дождевых осадков над этой территорией практически все соединения серы будут выведены из атмосферы в виде кислотного дождя. Необходимо отметить, что, несмотря на наметившееся в последние годы сокращение общего количества диоксида серы, выбрасываемого в атмосферу, серная кислота остается основным компонентом, приводящим к закислению атмосферных осадков. Еще один важный вывод из полученного решения состоит в необ-ходимости контроля содержания в атмосфере не только диоксида серы, но и серной кислоты и сульфатов. Контроль за этими соединениями становится особенно важным при удалении от источника выброса SO2. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 (числа – млн т элементной серы в год):
(числа – млн т элементной серы в год): (109)
(109) (110)
(110) (111)
(111)