Тема: Спектр атома водорода. Правило отбора
№1
Закон сохранения момента импульса накладывает ограничения на возможные переходы электрона в атоме с одного уровня на другой (правило отбора). В энергетическом спектре атома водорода (см. рис.) запрещенным является переход …

 4d→2s 4d→2s
4s→3p
2p→1s
3d→2p
Решение:
Для орбитального квантового числа l существует правило отбора  .. Это означает, что возможны только такие переходы, в которых l изменяется на единицу. Поэтому запрещенным переходом является переход 4d→2s так как в этом случае .. Это означает, что возможны только такие переходы, в которых l изменяется на единицу. Поэтому запрещенным переходом является переход 4d→2s так как в этом случае  . .

№2
На рисунке дана схема энергетических уровней атома водорода.
Наибольшая длина волны спектральной линии (в нм) серии Лаймана равна …
(h = 6,63·10-34 Дж·с)
 122 122
Решение:
Серию Лаймана дают переходы в состояние с n = 1. Учитывая связь длины волны и частоты
 и правило частот Бора и правило частот Бора  , можно сделать вывод о том, что линии с наибольшей длиной волны (то есть с наименьшей частотой) в серии Лаймана соответствует переход со второго энергетического уровня. Тогда , можно сделать вывод о том, что линии с наибольшей длиной волны (то есть с наименьшей частотой) в серии Лаймана соответствует переход со второго энергетического уровня. Тогда

№3
 На рисунке схематически изображены стационарные орбиты электрона в атоме водорода согласно модели Бора, а также показаны переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. На рисунке схематически изображены стационарные орбиты электрона в атоме водорода согласно модели Бора, а также показаны переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена.
Наибольшей частоте кванта в серии Пашена (для переходов, представленных на рисунке) соответствует переход …
 n =5→n =3 n =5→n =3
n=4→n=3
n=5→n=2
n=5→n=1
Решение:
Серию Пашена дают переходы на третий энергетический уровень, при этом энергия испускаемого кванта, а следовательно, и его частота зависят от разности энергий электрона в начальном и конечном состояниях. Поэтому наибольшей частоте кванта в серии Пашена (для переходов, представленных на рисунке) соответствует переход  . .
№4
Собственные функции электрона в атоме водорода  содержат три целочисленных параметра: n, l и m. Параметр n называется главным квантовым числом, параметры l и m – орбитальным (азимутальным) и магнитным квантовыми числами соответственно. Орбитальное квантовое число l определяет … содержат три целочисленных параметра: n, l и m. Параметр n называется главным квантовым числом, параметры l и m – орбитальным (азимутальным) и магнитным квантовыми числами соответственно. Орбитальное квантовое число l определяет …
 модуль орбитального момента импульса электрона модуль орбитального момента импульса электрона
энергию электрона в атоме водорода
проекцию орбитального момента импульса электрона на некоторое направление
модуль собственного момента импульса электрона
Решение:
Орбитальное (азимутальное) квантовое число l определяет модуль орбитального момента импульса электрона:  . .
№5
На рисунке дана схема энергетических уровней атома водорода, а также условно изображены переходы электрона с одного уровня на другой, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой области – серию Бальмера, в инфракрасной области – серию Пашена и т.д.

Отношение максимальной частоты линии в серии Пашена  к минимальной частоте линии в серии Бальмера к минимальной частоте линии в серии Бальмера 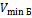 равно … равно …
 4/5 4/5
1/3
4/27
5/36
Решение:
Серию Пашена дают переходы на третий энергетический уровень, серию Бальмера – на второй уровень. Максимальная частота линии в серии Пашена
 Минимальная частота линии в серии Бальмера Минимальная частота линии в серии Бальмера
 Тогда Тогда 
№6
Закон сохранения импульса накладывает ограничения на возможные переходы электрона в атоме с одного уровня на другой.(правило отбора).В энергетическом спектре атома водорода(см.рис.)запрещенным переходом яв-ся…
Решение:
Для орбитального квантового числа  имеется правило отбора имеется правило отбора  Это означает, что возможны только такие переходы , в которых Это означает, что возможны только такие переходы , в которых  изменяется на единицу. Поэтому запрещенным переходом яв-ся изменяется на единицу. Поэтому запрещенным переходом яв-ся  .Варианты ответа: .Варианты ответа: 
№7
Положение бусинки массы  и положение электрона ( и положение электрона (  ) )
определены с одинаковой погрешностью .  Если квантомеханическая неопределенность х-компоненты скорости бусинки составляет примерно Если квантомеханическая неопределенность х-компоненты скорости бусинки составляет примерно  , ,
то для электрона неопределенность 
Решение:
Из соотношения неопределенности Гейзенберга для координаты и соответствующей компоненты импульса  следует, что следует, что  неопределенность координаты, неопределенность координаты,
 неопределенность х-компоненты импульса, неопределенность х-компоненты импульса, 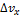 неопределенность х-компоненты скорости,m- масса частица,h- постоянная Планка, деленная на 2 неопределенность х-компоненты скорости,m- масса частица,h- постоянная Планка, деленная на 2  Неопределенность х-компонеты скорости можно найти из соотношения Неопределенность х-компонеты скорости можно найти из соотношения  .Значит,для бусинки и электрона можна записать соотношение: .Значит,для бусинки и электрона можна записать соотношение:  ,откуда ,откуда 
Варианты ответа: 
№8
Собственные функции электрона в атоме водорода  содержат три целочисленных параметра содержат три целочисленных параметра  . Параметр . Параметр  называется главным квантовыми числами соответственно. Магнитное квантовое число называется главным квантовыми числами соответственно. Магнитное квантовое число  определяет … определяет …
Решение.
Главное квантовое число  определяет энергию электрона в атоме водорода: определяет энергию электрона в атоме водорода:
 . Орбитальное . Орбитальное 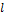 и магнитное и магнитное  квантовые числа определяют модуль орбитального момента импульса квантовые числа определяют модуль орбитального момента импульса 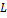 и его проекцию и его проекцию  на некоторое направление на некоторое направление 
По следующим формулам:  и и  . .
Модуль собственного момента импульса электрона
Энергию электрона в атоме водорода
Модуль орбитального момента импульса электрона
ü Проекцию орбитального момента импульса электрона на некоторое направление
Не нашли, что искали? Воспользуйтесь поиском по сайту:
©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|



 4d→2s
4d→2s .. Это означает, что возможны только такие переходы, в которых l изменяется на единицу. Поэтому запрещенным переходом является переход 4d→2s так как в этом случае
.. Это означает, что возможны только такие переходы, в которых l изменяется на единицу. Поэтому запрещенным переходом является переход 4d→2s так как в этом случае  .
.
 и правило частот Бора
и правило частот Бора  , можно сделать вывод о том, что линии с наибольшей длиной волны (то есть с наименьшей частотой) в серии Лаймана соответствует переход со второго энергетического уровня. Тогда
, можно сделать вывод о том, что линии с наибольшей длиной волны (то есть с наименьшей частотой) в серии Лаймана соответствует переход со второго энергетического уровня. Тогда
 На рисунке схематически изображены стационарные орбиты электрона в атоме водорода согласно модели Бора, а также показаны переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена.
На рисунке схематически изображены стационарные орбиты электрона в атоме водорода согласно модели Бора, а также показаны переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. .
. содержат три целочисленных параметра: n, l и m. Параметр n называется главным квантовым числом, параметры l и m – орбитальным (азимутальным) и магнитным квантовыми числами соответственно. Орбитальное квантовое число l определяет …
содержат три целочисленных параметра: n, l и m. Параметр n называется главным квантовым числом, параметры l и m – орбитальным (азимутальным) и магнитным квантовыми числами соответственно. Орбитальное квантовое число l определяет … .
. к минимальной частоте линии в серии Бальмера
к минимальной частоте линии в серии Бальмера 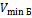 равно …
равно … Минимальная частота линии в серии Бальмера
Минимальная частота линии в серии Бальмера Тогда
Тогда 
 имеется правило отбора
имеется правило отбора  Это означает, что возможны только такие переходы , в которых
Это означает, что возможны только такие переходы , в которых  изменяется на единицу. Поэтому запрещенным переходом яв-ся
изменяется на единицу. Поэтому запрещенным переходом яв-ся  .Варианты ответа:
.Варианты ответа: 
 и положение электрона (
и положение электрона (  )
) Если квантомеханическая неопределенность х-компоненты скорости бусинки составляет примерно
Если квантомеханическая неопределенность х-компоненты скорости бусинки составляет примерно  ,
,
 следует, что
следует, что  неопределенность координаты,
неопределенность координаты, неопределенность х-компоненты импульса,
неопределенность х-компоненты импульса, 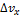 неопределенность х-компоненты скорости,m- масса частица,h- постоянная Планка, деленная на 2
неопределенность х-компоненты скорости,m- масса частица,h- постоянная Планка, деленная на 2  Неопределенность х-компонеты скорости можно найти из соотношения
Неопределенность х-компонеты скорости можно найти из соотношения  .Значит,для бусинки и электрона можна записать соотношение:
.Значит,для бусинки и электрона можна записать соотношение:  ,откуда
,откуда 

 содержат три целочисленных параметра
содержат три целочисленных параметра  . Параметр
. Параметр  называется главным квантовыми числами соответственно. Магнитное квантовое число
называется главным квантовыми числами соответственно. Магнитное квантовое число  определяет …
определяет … . Орбитальное
. Орбитальное 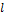 и магнитное
и магнитное 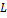 и его проекцию
и его проекцию  на некоторое направление
на некоторое направление 
 и
и  .
.