Тема: Распределения Максвелла и Больцмана
 №1 №1
На рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где  - доля молекул, скорости которых заключены в интервале скоростей от v до - доля молекул, скорости которых заключены в интервале скоростей от v до  в расчете на единицу этого интервала. в расчете на единицу этого интервала.
Для этой функции неверными являются утверждения, что …
 При понижении температуры величина максимума функции уменьшается При понижении температуры величина максимума функции уменьшается
 При понижении температуры площадь под кривой уменьшается При понижении температуры площадь под кривой уменьшается
С ростом температуры наиболее вероятная скорость молекул увеличивается
Положение максимума кривой зависит не только от температуры, но и от природы газа
Решение:
Полная вероятность равна:  то есть площадь, ограниченная кривой распределения Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее вероятной скорости , то есть площадь, ограниченная кривой распределения Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее вероятной скорости ,  и которой функция и которой функция  максимальна, следует, что при повышении температуры максимум функции сместится вправо, следовательно, высота максимума уменьшится. максимальна, следует, что при повышении температуры максимум функции сместится вправо, следовательно, высота максимума уменьшится.
 №2 №2
На рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где  – доля молекул, скорости которых заключены в интервале скоростей от – доля молекул, скорости которых заключены в интервале скоростей от  до до  в расчете на единицу этого интервала. в расчете на единицу этого интервала.
Для этой функции верными являются утверждения, что …
 с увеличением температуры максимум кривой смещается вправо с увеличением температуры максимум кривой смещается вправо
 при изменении температуры площадь под кривой не изменяется при изменении температуры площадь под кривой не изменяется
с увеличением температуры величина максимума функции увеличивается
при изменении температуры положение максимума не изменяется
Решение:
Полная вероятность равна:  , то есть площадь, ограниченная кривой распределения Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее вероятной скорости , то есть площадь, ограниченная кривой распределения Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее вероятной скорости  , при которой функция , при которой функция  максимальна, следует, что при повышении температуры максимум функции сместится вправо, следовательно, высота максимума уменьшится. максимальна, следует, что при повышении температуры максимум функции сместится вправо, следовательно, высота максимума уменьшится.
№3
 Зависимости давления Зависимости давления  идеального газа во внешнем однородном поле силы тяжести от высоты идеального газа во внешнем однородном поле силы тяжести от высоты  для двух разных температур представлены на рисунке. для двух разных температур представлены на рисунке.
Для графиков этих функций неверными являются утверждения, что …
 Температура Т1 выше температуры Т2 Температура Т1 выше температуры Т2
 давление газа на высоте h равно давлению на «нулевом уровне» (h = 0), если температура газа стремиться к абсолютному нулю давление газа на высоте h равно давлению на «нулевом уровне» (h = 0), если температура газа стремиться к абсолютному нулю
температура Т1 ниже температуры Т2
зависимость давления идеального газа от высоты определяется не только температурой газа, но и массой молекул.
Решение:
Зависимость давления идеального газа от высоты  для некоторой температуры для некоторой температуры  определяется барометрической формулой: определяется барометрической формулой:  , где , где  давление на высоте h=0, давление на высоте h=0, 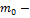 масса молекулы, g – ускорение свободного падения, k – постоянная Больцмана. Из формулы следует, что при постоянной температуре давление газа уменьшается с высотой по экспоненциальному закону тем медленнее, чем больше температура масса молекулы, g – ускорение свободного падения, k – постоянная Больцмана. Из формулы следует, что при постоянной температуре давление газа уменьшается с высотой по экспоненциальному закону тем медленнее, чем больше температура  . Давление . Давление  определяется весом всего газа и не меняется при изменении температуры. определяется весом всего газа и не меняется при изменении температуры.
 №4 №4
На рисунке представлены графики зависимости концентрации молекул идеального газа  от высоты от высоты  над уровнем моря для двух разных температур – над уровнем моря для двух разных температур –  (распределение Больцмана). (распределение Больцмана).
Для графиков этих функций верными являются утверждения, что …
 температура температура  выше температуры выше температуры 
 концентрация молекул газа на «нулевом уровне» (h=0) с повышением температуры уменьшается концентрация молекул газа на «нулевом уровне» (h=0) с повышением температуры уменьшается
температура  ниже температуры ниже температуры 
концентрация молекул газа на «нулевом уровне» (h=0) с повышением температуры увеличивается
Решение:
Зависимость концентрации молекул идеального газа от высоты для некоторой температуры Т определяется распределением Больцмана:  где где  концентрация молекул на высоте h=0, концентрация молекул на высоте h=0,  масса молекулы, g - ускорение свободного падения, k - постоянная Больцмана. Из формулы следует, что при постоянной температуре концентрация газа больше там, где меньше потенциальная энергия его молекул масса молекулы, g - ускорение свободного падения, k - постоянная Больцмана. Из формулы следует, что при постоянной температуре концентрация газа больше там, где меньше потенциальная энергия его молекул  , и уменьшается с высотой по экспоненциальному закону тем медленнее, чем больше температура: T2 >T1. С повышением температуры из-за увеличения энергии хаотического теплового движения молекулы более равномерно распределяются по высоте, и поэтому концентрация молекул газа на «нулевом уровне» h=0 уменьшается, а на высоте h увеличивается. , и уменьшается с высотой по экспоненциальному закону тем медленнее, чем больше температура: T2 >T1. С повышением температуры из-за увеличения энергии хаотического теплового движения молекулы более равномерно распределяются по высоте, и поэтому концентрация молекул газа на «нулевом уровне» h=0 уменьшается, а на высоте h увеличивается.
 №5 №5
На рисунке представлен график функции распределения молекул кислорода по скоростям(распределение Максвелла)для температуры Т=273 К, при скорости 380 м/с функция достигает максимума. Здесь  плотность вероятности или доля молекул, скорости которых заключены в интервале скоростей плотность вероятности или доля молекул, скорости которых заключены в интервале скоростей  в расчете на единицу этого интервала. Для распределения Максвелла справедливы утверждения, что… в расчете на единицу этого интервала. Для распределения Максвелла справедливы утверждения, что…
Решение:
 Функция распределения Максвелла f( Функция распределения Максвелла f(  имеет смысл плотности вероятности имеет смысл плотности вероятности  доля молекул, скорости которых заключены в интервале от доля молекул, скорости которых заключены в интервале от  .В нашем случае d .В нашем случае d  вблизи вблизи  наиболее вероятной скорости молекул, близкой к которой движется большее число молекул dN-число молекул, скорости которых заключены в интервале от 380 м/с до 385 м/с, N-число молекул газа. Площадь заштрихованной полоски наиболее вероятной скорости молекул, близкой к которой движется большее число молекул dN-число молекул, скорости которых заключены в интервале от 380 м/с до 385 м/с, N-число молекул газа. Площадь заштрихованной полоски  определяет долю молекул ,скорости которых заключены в интервале от 380 м/с до 385 м/с.С ростом температуры максимум кривой смещается вправо, высота максимума убывает. Наиболее вероятная скорость определяет долю молекул ,скорости которых заключены в интервале от 380 м/с до 385 м/с.С ростом температуры максимум кривой смещается вправо, высота максимума убывает. Наиболее вероятная скорость 
зависит от температуры газа: она увеличивается с повышением температуры. Вероятность того,
что величина скорости может принять хотя бы какое-нибудь значение (достоверное событие),
равна единице  поэтому при изменении температуры площадь под кривой остается равной единице. Если точно задана скорость поэтому при изменении температуры площадь под кривой остается равной единице. Если точно задана скорость  следовательно следовательно  . .
Вариантыответа: 



№6
Формула Больцмана  характеризует распределение частиц,находящихся в состоянии хаотического теплового движения ,в потенциальном силовом поле,в частности распределение молекул по высоте в изотермической атмосфере.Соотнесите рисунки и соответствующие им утверждения… характеризует распределение частиц,находящихся в состоянии хаотического теплового движения ,в потенциальном силовом поле,в частности распределение молекул по высоте в изотермической атмосфере.Соотнесите рисунки и соответствующие им утверждения…

Утверждения:
Распределение молекул по кинетическим энергиям.
Распределение молекул воздуха в атмосфере Земли.
Распределение молекул не является больцмановским и описывается функцией  . .
Распределение молекул в силовом поле при очень высокой температуре,когда энергия хаотического теплового движения значительно превосходит потенциальную энергию молекул.
Распределение молекул в силовом поле при температуре T  . .
Решение:
Концентрация молекул в однородном поле силы тяжести убывает с высотой по закону
 (распределение Больцмана на рис.3),где n-концентрация молекул на высоте (распределение Больцмана на рис.3),где n-концентрация молекул на высоте  , М-молярная масса, m- масса молекулы, g- ускорение свободного падения,R- универсальная газовая постоянная, k-постоянная Больцмана,T- температруа.В предельных случаях: если , М-молярная масса, m- масса молекулы, g- ускорение свободного падения,R- универсальная газовая постоянная, k-постоянная Больцмана,T- температруа.В предельных случаях: если  и молекулы равномерно распределяются по высоте(рис.1);если и молекулы равномерно распределяются по высоте(рис.1);если  и молекулы располагаются на нулевом уровне(рис.4).Если число молекул,имеющих большую потенциальную энергию,увеличивается по экспоненциальному закону и молекулы располагаются на нулевом уровне(рис.4).Если число молекул,имеющих большую потенциальную энергию,увеличивается по экспоненциальному закону  ,то такое распределение можно назвать «антибольцмановским», или инверсным(рис.2). ,то такое распределение можно назвать «антибольцмановским», или инверсным(рис.2).
Не нашли, что искали? Воспользуйтесь поиском по сайту:
©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 №1
№1 - доля молекул, скорости которых заключены в интервале скоростей от v до
- доля молекул, скорости которых заключены в интервале скоростей от v до  в расчете на единицу этого интервала.
в расчете на единицу этого интервала. При понижении температуры величина максимума функции уменьшается
При понижении температуры величина максимума функции уменьшается то есть площадь, ограниченная кривой распределения Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее вероятной скорости ,
то есть площадь, ограниченная кривой распределения Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее вероятной скорости ,  и которой функция
и которой функция  максимальна, следует, что при повышении температуры максимум функции сместится вправо, следовательно, высота максимума уменьшится.
максимальна, следует, что при повышении температуры максимум функции сместится вправо, следовательно, высота максимума уменьшится. №2
№2 до
до  в расчете на единицу этого интервала.
в расчете на единицу этого интервала. , то есть площадь, ограниченная кривой распределения Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее вероятной скорости
, то есть площадь, ограниченная кривой распределения Максвелла, равна единице и при изменении температуры не изменяется. Из формулы наиболее вероятной скорости  , при которой функция
, при которой функция  Зависимости давления
Зависимости давления  идеального газа во внешнем однородном поле силы тяжести от высоты
идеального газа во внешнем однородном поле силы тяжести от высоты  для двух разных температур представлены на рисунке.
для двух разных температур представлены на рисунке. определяется барометрической формулой:
определяется барометрической формулой:  , где
, где  давление на высоте h=0,
давление на высоте h=0, 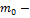 масса молекулы, g – ускорение свободного падения, k – постоянная Больцмана. Из формулы следует, что при постоянной температуре давление газа уменьшается с высотой по экспоненциальному закону тем медленнее, чем больше температура
масса молекулы, g – ускорение свободного падения, k – постоянная Больцмана. Из формулы следует, что при постоянной температуре давление газа уменьшается с высотой по экспоненциальному закону тем медленнее, чем больше температура  определяется весом всего газа и не меняется при изменении температуры.
определяется весом всего газа и не меняется при изменении температуры. №4
№4 от высоты
от высоты  (распределение Больцмана).
(распределение Больцмана). выше температуры
выше температуры 
 где
где  концентрация молекул на высоте h=0,
концентрация молекул на высоте h=0,  масса молекулы, g - ускорение свободного падения, k - постоянная Больцмана. Из формулы следует, что при постоянной температуре концентрация газа больше там, где меньше потенциальная энергия его молекул
масса молекулы, g - ускорение свободного падения, k - постоянная Больцмана. Из формулы следует, что при постоянной температуре концентрация газа больше там, где меньше потенциальная энергия его молекул  , и уменьшается с высотой по экспоненциальному закону тем медленнее, чем больше температура: T2 >T1. С повышением температуры из-за увеличения энергии хаотического теплового движения молекулы более равномерно распределяются по высоте, и поэтому концентрация молекул газа на «нулевом уровне» h=0 уменьшается, а на высоте h увеличивается.
, и уменьшается с высотой по экспоненциальному закону тем медленнее, чем больше температура: T2 >T1. С повышением температуры из-за увеличения энергии хаотического теплового движения молекулы более равномерно распределяются по высоте, и поэтому концентрация молекул газа на «нулевом уровне» h=0 уменьшается, а на высоте h увеличивается. №5
№5 плотность вероятности или доля молекул, скорости которых заключены в интервале скоростей
плотность вероятности или доля молекул, скорости которых заключены в интервале скоростей  в расчете на единицу этого интервала. Для распределения Максвелла справедливы утверждения, что…
в расчете на единицу этого интервала. Для распределения Максвелла справедливы утверждения, что… Функция распределения Максвелла f(
Функция распределения Максвелла f(  имеет смысл плотности вероятности
имеет смысл плотности вероятности  доля молекул, скорости которых заключены в интервале от
доля молекул, скорости которых заключены в интервале от  .В нашем случае d
.В нашем случае d  вблизи
вблизи  наиболее вероятной скорости молекул, близкой к которой движется большее число молекул dN-число молекул, скорости которых заключены в интервале от 380 м/с до 385 м/с, N-число молекул газа. Площадь заштрихованной полоски
наиболее вероятной скорости молекул, близкой к которой движется большее число молекул dN-число молекул, скорости которых заключены в интервале от 380 м/с до 385 м/с, N-число молекул газа. Площадь заштрихованной полоски  определяет долю молекул ,скорости которых заключены в интервале от 380 м/с до 385 м/с.С ростом температуры максимум кривой смещается вправо, высота максимума убывает. Наиболее вероятная скорость
определяет долю молекул ,скорости которых заключены в интервале от 380 м/с до 385 м/с.С ростом температуры максимум кривой смещается вправо, высота максимума убывает. Наиболее вероятная скорость 
 поэтому при изменении температуры площадь под кривой остается равной единице. Если точно задана скорость
поэтому при изменении температуры площадь под кривой остается равной единице. Если точно задана скорость  следовательно
следовательно  .
.



 характеризует распределение частиц,находящихся в состоянии хаотического теплового движения ,в потенциальном силовом поле,в частности распределение молекул по высоте в изотермической атмосфере.Соотнесите рисунки и соответствующие им утверждения…
характеризует распределение частиц,находящихся в состоянии хаотического теплового движения ,в потенциальном силовом поле,в частности распределение молекул по высоте в изотермической атмосфере.Соотнесите рисунки и соответствующие им утверждения…
 .
. .
. (распределение Больцмана на рис.3),где n-концентрация молекул на высоте
(распределение Больцмана на рис.3),где n-концентрация молекул на высоте  , М-молярная масса, m- масса молекулы, g- ускорение свободного падения,R- универсальная газовая постоянная, k-постоянная Больцмана,T- температруа.В предельных случаях: если
, М-молярная масса, m- масса молекулы, g- ускорение свободного падения,R- универсальная газовая постоянная, k-постоянная Больцмана,T- температруа.В предельных случаях: если  и молекулы равномерно распределяются по высоте(рис.1);если
и молекулы равномерно распределяются по высоте(рис.1);если  и молекулы располагаются на нулевом уровне(рис.4).Если число молекул,имеющих большую потенциальную энергию,увеличивается по экспоненциальному закону
и молекулы располагаются на нулевом уровне(рис.4).Если число молекул,имеющих большую потенциальную энергию,увеличивается по экспоненциальному закону