|
|
Подобный полиморфизм прямо связан с процессом презентации антигенных детерминант Т-клеткам.Возможно, столь высокий сбалансированный полиморфизм продуктов MHC обеспечивает более широкое разнообразие антигенов, распознаваемых иммунной системой данного вида, а также гетерозиса (гибридной силы), поскольку у гетерозигот возникает максимальная комбинаторика аллелей. Братья и сестры имеют один шанс из четырех быть идентичными по антигенам MHC.
98. Вирусные и бактериальные суперантигены. ● Суперантигенами являются некоторые белки, кодируемые бактериями и вирусами. Они активируют Т-клетки в свободном виде без необходимости предварительного процессинга и презентации на поверхности антигенпредставляющих клеток. Они неспецифически активируют до 20% всех Т-клеток, что приводит к чрезмерной продукции цитокинов и подавлению адаптивного иммунитета. Пример- стафилококковые энтеротоксины А и В, суперантиген вируса опухолей молочных желёз мышей.
● 99. Схема строения TCR и белки, входящие в состав Т-клеточного рецепторного комплекса. Это гетеродимерный белок, состоящий из двух полипептидных цепей— α и β либо γ и δ, представленных на поверхности клетки. Субъединицы закреплены в мембране и связаны друг с другом дисульфидной связью. По своей структуре субъединицы относятся к суперсемейству иммуноглобулинов. N-концевые части вариабельны, содержат CDR-участок. С-концевая часть константная. Так как сам TCR не может запустить каскад реакций, он агрегирован с CD3. CD3 комплекс связан с мотивами ITAM и с тирозинкиназой Fyn. αβ либо γδ гетеродимер вместе с CD3 комплексом образуют TCR.
100. Роль киназы lck в инициации сигнала с Т-клеточного рецептора. Под действием начального сигнала активации, поступающего от TCR, ассоциированная с CD4 или CD8 тирозинспецифицная протеинкиназа Lck фосфорилирует иммунорецепторные тирозинсодержащие активирующие мотивы, ITAM (immunoreceptor tyrosine-based activations motifs) в структуре ζ-цепей TCR:CD3-комплекса. Это приводит к привлечению и активации важных Src-киназ и запуску каскада, приводящего к активации транскрипционных факторов.
101. Последовательность перестройки V-генов γ-, δ-, β- и α-генов TCR. Вначале происходит перестройка генов TCR в δ, затем γ и β. Правда, это все нестрого, и реаранжировка цепей начинается практически одновременно. Вначале перестраиваются гены только на одной хромосоме, как и в случае V-генов иммуноглобулинов. В генах β- и δ-цепей сближаются сегменты D и J, а затем происходит полномасштабная перестройка с вовлечением основного сегмента V-гена и формированим непрерывных последовательностей VDJ. Реаранжировка генов γ-цепи проходит так же, но с одним отличием: поскольку в гене γ-цепи отсутствует D-сегмент, в результате перестройки формируется последовательность VJ. На этапе DN3 клетка должна сделать выбор: продолжать перестройку V-гена α-цепи для формирования TCR αβ-типа или довольствоваться уже сформированным γδTCR. В настоящее время наиболее широко принята концепция «силы сигнала», согласно которой, если γδTCR передают сигналы достаточной силы (заведомо превосходящей силу сигнала от пре-T-рецепторов), Т-клетки прекращают перестройку V-генов и развиваются как γδТ-лимфоциты. В противном случае экспрессия генов γ- и δ-цепей блокируется и клетки продолжают перестройку V-генов. Перестройка V-гена α-цепи делает физически невозможным развитие тимоцитов в направлении γδ-клеток, т.к. гены α- и δ-цепи образуют единый локус.
102. Роль протеинкиназ и фосфатаз в активации лимфоцитов. Фосфатазы: 1) CD45 обладает фосфатазной активностью, дефосфорилирует Lck и Fyn, приводя их в рабочее состояние. 2) Кальциневрин дефосфорилирует NF-AT, тот перемещается в ядро, переходит в свою зрелую форму и взаимодействует с промоторными участками ДНК. Протеинкиназы: 1) Fyn и Lck фосфорилируют ITAM => запуск киназы ZAP-70, с которой начинается сигнальный каскад. 2) Itk - тирозинкиназа, активирует PLCγ1. Та запускает каскад, в результате которого повышается внутриклеточная концентрация кальция и активируется кальциневрин. 3) Lck фосфорилирует PLCθ в зрелом иммунном синапсе, что приводит к предотвращению апоптоза и включению АР-1 (через каскад МАР-киназ) и NF-кВ (через киназу IKK).
103. Роль убиквитиновой системы в активации лимфоцитов. (лекция 5 с 29) Речь идет об активации транскрипционного фактора NF-kB. Он находится в цитоплазме, связанный с инактивирующей его субъединицей IкВ. Все начинается с того, что после полиубиквитинилирования активируются серин-треониновые киназы и создатеся фосфорилирующий комплекс, IKK фосфорилируется на этом комплексе. После этого IKK фосфорилирует ингибиторную субъединицу IкВ, после чего она приобретает способность к связыванию убиквитина, что предопределяет ее деградацию и активацию NF-kB. (очень коротко). Получается, что в зависимости от способа полимеризации убиквитина, передается тот или иной сигнал: ● активация серин-треониновых киназ (создание скаффолда для сборки на нем комплекса, фосфорилирующего IKK) ● после того, как IKK профосфорилирует ингибиторный кусок NFkB, сборка убиквитиновой цепи на нем будет сигналом к деградации ингибитора.
104. Роль мембранных фосфолипидов в активации лимфоцитов Активированные Src-киназы после удаления Ф с Lck привлекают ФосфолипазаС-гамму. Она расщепляет мембранные липиды (конкретно - PIP2) до DAG, который через PKC приводит в активное состояние NFkB и запускается транскрипция и ИФ3, который через увеличение внутриклеточного кальция (открывает депо ЭПР) активирует белок кальциневрин, который совместно с дефосфорилированием из-за повышения Cain NFAT приводит этот фактор в активное состояние, и опять запускается транскрипция. Понятно? -не очень. Можно еще добавить про ветвление сигнального пути (т.к. образуются ИТФ и ДАГ сразу). А еще, что в результате костимуляции через CD28 запускается синтез этого самого PIP2.
105. Динамика формирования и структура иммунологического синапса. Формирование синапса сопровождается мощными перестройками цитоскелета Т-лимфоцита и его (лимфоцита) поляризацией. - На начальном этапе в центре синапса находятся молекулы адгезии, а всякие сигнальные рецепторы - на периферии. - Дальше ситуация зависит от того, каким будет синапс. - Если это активирующий синапс, то активирующие комплексы (рецептор TCR, связанный с MHC) мигрируют в центр синапса, а молекулы адгезии смещаются на периферию. - Если синапс ингибирующий, то регуляторные комплексы рецепторов с мишенями (комплекс KIR с MHCI, например) остаются на периферии, образуя ингибиторное кольцо. 106. Последовательности ITAM и ITIM, их сходства и отличия. Immunoreceptor thyrosine-based activation motif Immunoreceptor thyrosine-based inhibition motif
● ITAM Фосфорилируется по тирозину (Y) Scr-киназами, рекрутирует Syk-киназы, локализуется во внутриклеточной части рецепторов TCR, BCR, Fc и др. Активация клетки ● ITIM Фосфорилируются по тирозину (Y) Scr-киназами, рекрутируют фосфатазы SHP1,2, SHIP. Локализируются во внутриклеточной части рецепторов KIR, СD94/NKG2A и др. Подавление активации клетки (из лекции 5 слайд 9)
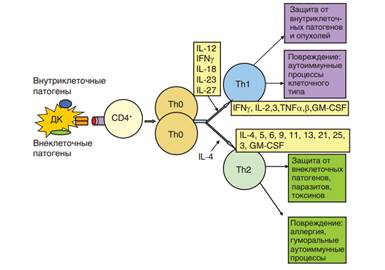
107. Основные семейства транскрипционных факторов, активируемые сигналами рецепторов лимфоцитов и костимуляции. . NF-kB, NFAT, AP-1 108. Три вида сигналов, необходимых для активации и дифференцировки эффекторных Т-лимфоцитов. 1. Сигналы активации (специфический) TCR-MHC - презентация, распознавание пептида, запуск сигнала активации. CD4 / CD8 -MHC- распознавание MHC (I или II, соответственно) 2. Сигнал костимуляции СD80/86 - CD28 - костимуляция или CTLA-4 -нет костимуляции CTLA-4 экспрессируется на уже активированных Т-клетках. Гомологичен CD28, но связывание с CD80/86 приводит к подавлению активации Т-клетки. Связывание в 1-2,5К раз более авидное за счет образования кластеров. 3. Сигнал дифферецировки (цитокиновый) 109. Главные индукторы дифференцировки Th1 и Th2 хелперов из Th0. Дифференцировка Th1 и Th2 зависит, как минимум, от двух факторов. Один из них поступает через TCR и сообщает о распознавании антигена с молекулой MHC. Второй сигнал поставляют цитокины. Цитокины обладают селективной функцией. Направление дифференцировки Th задаётся при передаче сигнала через TCR, а цитокины выбирают ту или иную популяцию, обеспечивая её факторами выживания и пролиферации. Развитию Th1 способствует очень высокое сродство к рецептору. Развитию Th2 - промежуточные дозы антигена и более низкое сродство. А еще разные типы дендритных клеток, и можно поговорить про факторы их развития. Антигены для Th1 - лейшмании, трипаносомы, хламидии, микобактерии; для Th2 - шистосомы, вирусы осп, кори, протеазы паразитов. Из цитокинов для Th1 основной - IL-12 и IFNγ; IL-18, IL-23 - развитие и поддержание Th1-ответа. Для Th2 - только IL-4. Транскрипционные факторы для Th1 - STAT4 и STAT1, для Th2 - STAT6.
110. Транскрипционный фактор, необходимый и достаточный для дифференцировки регуляторных Т-лимфоцитов. FOXP3 111. Цитокины, определяющие дифференцировку CD4+ Т-лимфоцитов в Th1-, Th2- и Th17-клетки. Th1 - Il-12, IFNy (STAT4, STAT1 - транскрипционный фактор), IL18, IL23 развитие и поддержание Th1ответа. Th2 - IL-4 (STAT6) Th17 - IL-6, TGFb(STAT3); IL-21, IL-23
112. Роль регуляторных Т-лимфоцитов в развитии и контроле иммунного ответа. - ограничивают аутоиммунные реакции Т-клеток (естественные регуляторные Т-лимфоциты) - сдерживают экспансию клонов Т-клеток, вовлечённых в иммунный ответ (адаптивные регуляторные Т-лимфоциты). Адаптивные регуляторные Т-лимфоциты главным образом ограничивают иммунный ответ на заключительных этапах его развития.
113. Иммунная система слизистых оболочек и кожи. Миграция лимфоцитов в барьерные ткани. 1) Слизистые (всегда - в пищеварительном тракте, реже - в др. слизистых). Специализированные М-клетки эпителия перетаскивают АГ через слизистую в лимфоидные структуры. Лимфоидная ткань может быть представлена как организованными структурами, так и диффузной лимфоидной тканью. Различают: ● афферентный отдел (ответственный за прием и обработку иммунологической информации и представленный, в основном, организованными структурами - MALT, Mucosa-associated lymphoid tissue). Организованные структуры: пейеровы бляшки (аналог лимфоузлов) и фолликулы. Бляшки - аналог лимфоузлов в местах максимальной АГ нагрузки тонкого кишечника. ● эфферентный (представленный диффузной тканью). 2) Кожа. В коже лимфоидная ткань развита в меньшей степени (поступает меньше АГ, потому что ороговевшая и нет М-клеток). Только диффузные лимфоидные элементы. Афферентное звено - обычные миелоидные ДК и клетки Лангерганса. Эфферентный отдел - как в слизистых. 3) Миграция. Лимфоидные ткани различных слизистых связаны. В то же время, пути рециркуляции в слизистых автономны, по ср. с другими. Проникновение клеток в слизистые кишечника требует экспрессии дополнительных "молекул хоминга": кроме стандартных молекул хоминга и хемокиновых рецепторов нужны особые, избирательно экспрессированные в кишечнике (например, интегрин α4β7, распознающий молекулы MadCAM эндотелия сосудов кишечника). То есть все Т-клетки из слизистой оболочки кишечника могут мигрировать в другие слизистые, но только часть лимфоцитов из других слизистых может попасть в слизистую кишечника). При индукции иммунного ответа активированные лимфоциты предпочитают мигрировать туда, откуда пришли индуцировавшие их клетки.
114. Иммунологическая память. Преимущества вторичного иммунного ответа перед первичным. коротко: вторичный иммунный ответ развивается быстрее ( из-за того что клеткам памяти не нужно перестраиваться) и более мощно по сравнению с первичным. характеризуется более высоким сродством АТ к АГ. Для него нужно меньшее количество АГ и при этом запуск ответа происходит не дожидаясь, пока АГ попадет в региональный лимф. узел, а в месте, где АГ проникло в организм. Клетки памяти - Т и В лимфоциты, не участвовавшие в первичном иммунном ответе, но сохранившие в себе сплайс-варианты необходимые для успешного распознавания АГ подробнее:Преимущества вторичного иммунного ответа перед первичным — результат формирования иммунологической памяти. Эти преимущества обусловлены рядом факторов. ● Исходная численность каждого клона клеток памяти на 2–3 порядка выше, чем клона наивных клеток. ● Клетки памяти пребывают в клеточном цикле, а наивные лимфоциты — в фазе покоя (G0), для выхода из которой им требуется время и особые воздействия (активация). ● При действии антигена клетки памяти не должны проходить некоторые стадии развития (в случае В-клеток — переключение изотипов, мутагенез V-генов и созревание аффинитета; в случае Т-клеток — формирование связей TCR с корецепторами, перемещение TCR в рафты, дифференцировку Th1/Th2; для всех лимфоцитов — изменение спектра хемокиновых рецепторов). ● Клетки памяти быстрее и эффективнее реагируют на антиген (активируются, дифференцируются в эффекторные клетки), что обусловлено изменениями сигнальных путей. Так, изоформа CD45R0, характерная для клеток памяти, способствует более быстрой активации, чем CD45RA, свойственная наивным Т-клеткам. В результате Т-клетки памяти могут быть активированы при презентации антигена любыми АПК, тогда как наивные Т-клетки — только дендритными клетками. ● В силу более интенсивной рециркуляции и способности мигрировать в барьерные и нелимфоидные ткани Т-клетки памяти с большей вероятностью могут «встретить» антиген. Этот антиген может быть презентирован им на месте, а не только во вторичных лимфоидных органах, как в случае наивных Т-клеток.
115. Современные подходы к конструированию вакцин. 1. Инактивированные - убитые бактерии или вирусы, 2. Аттенюированные - ослабленные микроогранизмы, сохраняющие свои свойства, но потерявшие способность вызывать выраженное заболевание. 3. Микроорганизмы в качестве векторов для чужеродных антигенов. 4. Вакцины из микробных компонентов, выполняющих роль индивидуальных протективных антигенов. 5. Антигены синтезируемые с помощью клонирования генов. 6. “Голая” ДНК. Плазмиды вводятся в огранизм путем бомбардировки частицами золота, покрытыми плазмидами, которые несут ген, кодирующий антиген вакцины. 7. Трансгенные растения. Могут быть использованы для для получения вирусных и бактериальных антигенов, таких как HBsAg, гликопротеин вируса бешенства и энтеротоксин Escherichia сoli. (по Основы медицинской иммунологии, А.Рабсон, А. Ройт, П. Делвиз, 2006)
116. Роль адъювантов в составе вакцин. ● Адъювант — соединение или комплекс веществ, используемое для усиления иммунного ответа при введении одновременно с иммуногеном при вакцинации. самый известный - адъювант Фрейнда Основное свойство большинства адъювантов - способность их депонировать антиген, то есть адсорбировать его на своей поверхности и длительное время сохранять в организме, что увеличивает продолжительность его влияния на иммунную систему. ● Большинство современных вакцин разрабатывается на основе определенных антигенов (АГ) в отличие от полностью инактивированных или аттенуированных патогенов. АГ микроорганизмов, опухолевых клеток или аллергенов, вводятся в организм человека в виде очищенных белков. Но такие «молекулярные вакцины» могут в некоторых случаях, обладать слабой иммуногенностью, и для усиления иммунного ответа со стороны иммунной системы человека к ним необходимо добавлять адъюванты. КРАТКО: для усиления иммунного ответа на вакцину со стороны иммунной системы Можно добавить: наиболее важной сейчас представляется способность адъюванта активировать врожденный иммунитет, конкретно - АПК.
117. Механизмы иммунологического надзора над опухолями. . Т-лимфоциты - следят за антигенным составом собственных клеток, элиминация трансформированных клеток (с измененными антигенами на поверхности). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|