|
|
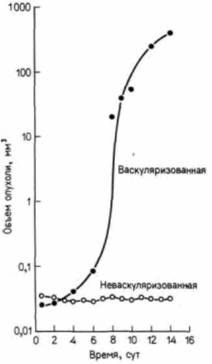
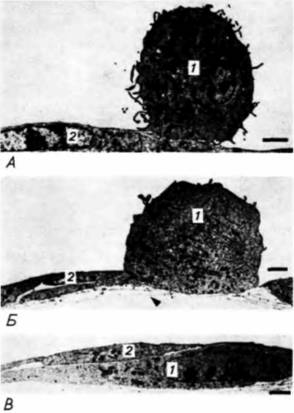
Дополнительные сведения и гипотезы: Ангиогенез, индуцированный опухольюУ каждого человека за день происходит до 350 миллиардов митозов (Folkman, 1974). С каждым клеточным делением возрастает возможность того, что образовавшиеся в результате деления клетки станут злокачественными. В действительности же опухоли развиваются крайне редко. Фолкман предположил, что клетки, способные к формированию опухолей, появляются с определенной частотой, но подавляющее большинство их не может реализовать эту способность. Причина этого заключается в том, что для выживания солидной опухоли, как и любой быстро делящейся ткани, необходимы кислород и питательные вещества. Без снабжения кровью потенциальные опухоли либо погибнут, либо будут сохраняться в «дремлющем» (скрытом, латентном) состоянии. Такие «микроопухоли» остаются стабильной клеточной популяцией, в которой погибающие клетки замещаются новыми. Решающим моментом для превращения этого узелка опухолевых клеток в быстрорастущую опухоль является васкуляризация. На рис. 6.29 показан экспоненциальный рост такой опухоли. Через две недели после васкуляризации первоначальный объем микроопухоли может увеличиться в 16 000 раз. Без снабжения кровью опухоль не растет (Folkman, 1974; Ausprunk. Folkman. 1977). Для того чтобы васкуляризация произошла, в микроопухоли образуются вещества, называемые опухолевыми факторами ангиогенеза. Один такой фактор ангиогенин— был выделен из популяции опухолевых клеток человека; он оказался одноцепочечным белком с молекулярной массой примерно 14 400 дальтон (Fett et al., 1985). Опухолевые факторы ангиогенеза стимулируют митозы эндотелиальных клеток и формирование из этих клеток сосудов, направляющихся к опухоли. Это явление можно продемонстрировать, имплантировав кусочек опухолевой ткани между слоями роговицы кролика или мыши. Роговица не васкуляризована, но она окружена сосудистым ободком (лимбом). Опухолевая ткань индуцирует образование кровеносных сосудов, растущих по направлению к опухоли (рис. 6.30). Большая часть других тканей взрослого организма не индуцирует формирования сосудов. (Исключение составляют стимулированные антигенами лимфоциты и макрофаги, секретирующие ангиогенные факторы, которые, вероятно, участвуют в заживлении раны.) Очищенный ангиогенин даже в дозе 3,5 пикомоля может индуцировать обширную васкуляризацию роговицы у кролика. Как только кровеносные сосуды вступают в опухоль, она начинает бурно расти и в конце концов разрушает глаз. Было показано (Folkman et al., 1983), что некоторые природные вещества подавляют ангиогенез, индуцированный опухолью. Гепарин сложный полисахарид, обнаруженный в матриксе многочисленных соединительнотканных образований является мощным ингибитором ангиогенеза, особенно если он вводится вместе со стероидным гормоном кортизоном. У мышей с твердо установленными опухоля-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 210 ГЛАВА 6______ __________________
ми, получающих инъекции гепарина и кортизона, эти опухоли заметно регрессируют (уменьшаются). Комбинация гепарина с кортизоном подавляет и нормальный ангиогенез у куриных зародышей. Помимо того, что новообразованные кровеносные сосуды снабжают опухоли кислородом и питательными веществами, они также представляют собой путь, который облегчает миграцию опухолевых клеток к новым местам и тем самым формирование вторичных опухолей. Этот процесс называется метастазированием. В результате большая часть больных со злокачественными опухолями умирает не от исходной (первичной) опухоли, а от многочисленных вторичных опухолей, распространяющихся путем метастазирования. Чтобы попасть в кровеносный сосуд, опухолевая клетка должна лизировать (растворить) коллагеновый матрикс, окружающий новые капилляры. Полагают, что лизис осуществляется с помощью секреции протеолитического фермента, называемого активатором плазминогена. Этот фермент играет важную роль в имплантации бластоцисты в матку (см. гл. 3). Опухолевые клетки используют тот же самый фермент, чтобы проделать отверстие в коллагеновом матриксе, окружающем кровеносные сосуды. Синтез активатора плазминогена коррелирует со способностью опухоли метастазировать; было обнаружено, что антитела против этого фермента подавляют рост метастазов у человека (Ossowski, Reich, 1983). Попав на эндотелиальные клетки капилляров, метастазирующая опухолевая клетка может протиснуться между ними и попасть в кровоток (Kramer, Nicolson, 1979). На рис. 6.31 по-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. ________________ РАННЕЕ РАЗВИТИЕ ПОЗВОНОЧНЫХ. МЕЗОДЕРМА И ЭНТОДЕРМА_______________________ 211
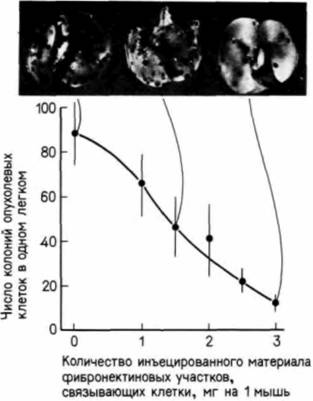
казано, как метастазирующая клетка злокачественной меланомы прокладывает себе путь внутрь сосуда между эндотелиальными клетками. Для метастазирования необходимо, чтобы клетка была способна перемещаться от одного места к другому. Подобно эмбриональным клеткам, многие опухолевые клетки нуждаются в поверхности, по которой могут мигрировать, а некоторые из этих клеток движутся по внеклеточному матриксу, образованному клетками эндотелия кровеносных сосудов( Nicolson et al.. 1981). Эта миграция, как и миграция многих эмбриональных клеток, по-видимому, осуществляется с помощью фибронектина. У мышей, которым инъецированы опухолевые клетки определенной линии меланомы, эти клетки специфически мигрируют в легкие, где и формируют вторичные опухоли (рис. 6.32). Если клетки меланомы предварительно инкубируют в среде, содержащей фибронектин или его участок, связывающийся с клетками (так чтобы клетка не могла связываться с собственным фибронектином хозяина), то около 90% инъецированных клеток не достигают легких (Humphries et al., 1986). По способности быстро делиться, секретировать активатор плазминогена и ангиогенный фактор, а также по характеру миграции опухолевые клетки сходны с нормальными эмбриональными клетками. Нередко опухолевые клетки это клетки взрослого организма, но вернувшиеся к эмбриональной стадии своего существования. Эти данные позволяли предложить новые подходы к терапии рака, включая введение агентов, которые предотвращают ангиогенез или действительно способствуют дифференцировке «эмбриональной» опухолевой клетки в нормальную «взрослую» клетку (Sachs, 1978; Jimenez, Yunis, 1987).
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 212_______________ ГЛАВА 6_______________________________________________________________________________ Развитие клеток крови 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|