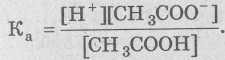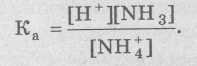|
|
Природа ионизации, константа и степень ионизации
Процессы ионизации веществ в значительной степени определяют биологическую активность чужеродных соединений. Ионы и незаряженные молекулы различаются по своим физико-химическим свойствам: · вступают в разные химические реакции, · по-разному проникают через мембраны, · по-разному адсорбируются на различных поверхностях и т.д. Большинство биологически активных веществ представляют собой кислоты, основания и соли и, следовательно, являются электролитами (повышают электропроводность воды). Вспомним: Все электролиты понижают температуру замерзания воды в значительно большей степени, чем можно было бы ожидать исходя из их молярной концентрации. Это послужило основанием для создания Аррениусом теории ионизации электролитов. Например, понижение температуры замерзания водного раствора сульфата натрия в сравнении с чистой водой в три раза больше ожидаемого объясняется тем, что при растворении Na2SО4 одна молекула дает три иона: два катиона натрия и один анион сульфата. Влияние степени ионизации на физиологическое действие слабых и сильных электролитов: 1) Вследствие полной ионизации в растворах биологические свойства солей, образованных сильной кислотой и сильным основанием, целиком определяются свойствами составляющих их ионов. Так, физиологическое действие хлорида кальция определяется действием ионов кальция и хлора. При этом Физиологическое действие полностью ионизирующейся соли не может быть меньше или больше суммы действия ее ионов. 2) Если соль образована слабой кислотой или слабым основанием, то в результате гидролиза происходит высвобождение некоторого количества незаряженных частиц (образование молекул слабых электролитов), биологическое действие которых суммируется с эффектами, вызванными ионами. Степень ионизации в растворе определяется двумя факторами: · рН раствора · рКа кислоты (или основания).
рКа (константа кислотности, или константа ионизации) является постоянной величиной для каждой кислоты или основания. Поэтому при определенной величине рН степень ионизации зависит только от природы кислоты (или основания), при этом не важно, были они нейтрализованы или нет. В теории ионизации Аррениус применил закон действующих масс для описания состояния ионного равновесия. СН3СООН ↔ Н+ + СН3СОО− Соотношение
всегда является постоянной величиной и определяет константу кислотности Ка или просто константу ионизации данной кислоты: Величина Ка (СН3СООН) определяется экспериментально и составляет 1,7∙10-5 (при температуре 25 °С). Состояние ионизации слабых оснований также может быть охарактеризовано константами кислотности. Например, аммиак − слабое основание, которое может присоединить ионы водорода с образованием ионов аммония. В таком случае ион NH4+ можно рассматривать как слабую кислоту: NH4+ ↔ Н+ + NH3 Тогда,
Ка (NH4+) = 1,7∙10-5 (при температуре 25 °С). Таким образом, основание можно характеризовать количественно сродством к иону водорода. Это позволяет применить константы кислотности для описания процесса ионизации как для кислот, так и для оснований. Т.к., величины констант ионизации слишком малы, при расчетах используют их отрицательные логарифмы: рKa = −lgKa (рH = −lgH). Тогда при 25 °С рКа (СН3СООН) = 4,76, рКа (NH4+) = 9,26. Для кислот: ü Чем сильнее кислота, тем ниже ее рКа (чем сильнее основание, тем выше его рКа). ü Величина рКа, близкая к 5, типична для большинства монокарбоновых кислот (алифатических и ароматических). ü Кислоты c рКа > 7 практически не изменяют цвета нейтральной индикаторной бумаги. ü Кислоты с рКа > 10 — не имеют кислого вкуса. Для оснований: ü рКа 11 (например, этиламин) типична для алифатических оснований, ü рКа 5 — типична для ароматических, которые слабее первых; ü многие алкалоиды и другие биологически активные основания имеют значения рКа около 8. ü Основания с рКа < 7, практически не изменяют цвета нейтральной индикаторной бумаги.
степень ионизации кислот (% )
степень ионизации оснований (%) =
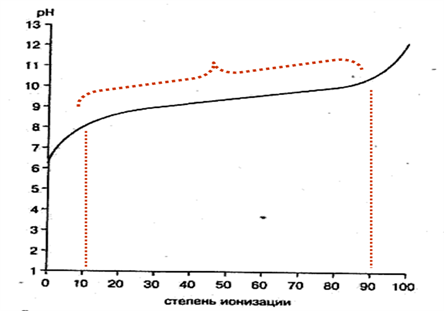
Уравнения свидетельствуют о том, что степень ионизации данной кислоты (основания) зависит от рН. Эта зависимость не является линейной, а выражается сигмоидной кривой.
Небольшое изменение рН в определенной области может вызывать сильные изменения ионизации, особенно если значение рН раствора близко к величине рКа исследуемого вещества Значение рН, при котором кислота или основание ионизированы наполовину, эквивалентно их рКа. Если рН на одну единицу ниже, чем рКа, то кислота ионизирована на 9 %, а основание — на 91 %.


9.Различия в ионизации, обеспечивающие избирательность
В зависимости от степени ионизации ксенобиотики обладают различной биологической активностью и подразделяются на три группы: • ксенобиотики, обладающие большей биологической активностью в ионизированном состоянии; • ксенобиотики, более активные в неионизированном состоянии; • ксенобиотики, проявляющие биологическую активность в виде ионов и неионизированных молекул. Вещества, обладающие большей биологической активностью в ионизированном состоянии. Многие органические катионы обладают антибактериальной активностью: алифатические амины, существующие при рН 7 в основном в виде катионов (ароматические амины при рН 7 находятся в неионизированном состоянии и бактерицидным действием не обладают В 20-х годах XX в. антибактериальная активность подобных антисептиков объяснялась щелочностью их водных растворов. В 30-х годах XX в. было высказано предположение о том, что антибактериальная активность трифенилметановых красителей объясняется взаимодействием катиона красителей с определенными анионными группами на поверхностях бактерий. Исследования аминоакридинов, проведенные Альбертом с сотр. (1941), показали, что существует количественная связь между их антибактериальным действием и степенью ионизации по катионному типу.
Ксенобиотики, более активные в неионизированнот состоянии. Неионизированные вещества могут обладать очень сильным физиологическим действием (эфир, хлороформ и др.). В 1921 г. Вермст обнаружил, что многие слабые кислоты наиболее полно проявляют физиологическую активность в наименее ионизированном состоянии.
Ингибирование деления клеток яиц иглокожих салициловой кислотой.
При изучении действия слабых кислот на биологические объекты доказано, что количество вещества, необходимое для достижения эффекта, остается постоянным независимо от рН среды при условии, что рН по меньшей мере на одну единицу ниже, чем рКа; в этом случае не происходит ионизации токсического агента. В других опытах было доказано, что эффективность слабых оснований возрастает с повышением рН, т.е. пропорционально снижению их ионизации. При этом в опытах на червя Arenicola было выяснено, что изменение рН среды не влияет на тест−объект. Таким образом, ü эффективность слабых оснований (кокаин и др.) возрастает с повышением рН, т.е. пропорционально подавлению ионизации. ü эффективность слабых кислот повышается при уменьшении рН (так же с подавлением ионизации). Ксенобиотики, проявляющие биологическую активность в виде ионов и неионизированных молекул. Среди этой группы ксенобиотиков следует различать вещества,
Многие вещества, особенно со значениями рКа в пределах от 6 до 8, проникнув в клетки в виде неионизированных молекул, проявляют свое биологическое действие как ионы. Например, 1) поступление бензойной кислоты в клетки дрожжей обратно пропорционально степени ионизации; 2) ряд ионизирующихся азотсодержащих гетероциклов сильно ингибируют реакцию Хилла при фотосинтезе. При слишком высокой степени ионизации активность этих соединений исчезает. Это объясняется проникновением ингибиторов через мембрану в виде неионизированных молекул, а затем действием их как анионов; 3) такой механизм характерен для некоторых гербицидов. 4) основание триметиламин (хлоридин, рКа=7,2), лучше поглощается клетками из щелочных растворов в виде неионизированных молекул, а ингибирование ключевого фермента клетки (дигидрофолатредуктаза) осуществляют только катионы; 5) примерно 16 % большинства алкалоидов (рКа около 8) при рН 7,3 остаются неионизированными. Они проникают в клетки в виде молекул, а биологическое действие осуществляют в виде катионов.
II. Биологическая активность многих ксенобиотиков определяется действием неионизированных молекул и ионизированной части вещества.
Например, 1) Ингибирование роста гриба Мuсоr бензойной кислотой. 2) фунгицидное действие 2,4-динитрофенола (рКа 4,0) на грибы Trichoderma viride при различных значениях рН.
На взаимодействие ксенобиотиков с мембраной оказывает влияние ионизация мест связывания. Так, катионные препараты связываются с анионными центрами, которые могут иметь значения рКа от 2 до 7 (при наличии фосфатных групп), от 2 до 6 (при наличии карбоксильных групп) или 10 (в присутствии остатков тирозина, пиримидина, цистеина); катионные центры должны иметь значения рКа 4 (аденин), 7 (гистидин), 10 (лизин), 13 (аргинин).
Выводы: 1) При изучении биологического действия ксенобиотиков важно знать их константы ионизации. 2) Необходимо установить, в какой форме эти вещества более эффективны — в виде ионов, неионизированных молекул или совокупности того и другого (суммарный биологический эффект).

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|