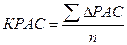|
|
В некоторых видах продуктов, г на 100 г белка
Лимитирующей биологическую ценность аминокислотой считается та, скор которой наименьший.
где ∆РАС – избыток скора аминокислоты; n – количество незаменимых аминокислот.
∆РАС = Сi - Сmin
где Сi – избыток скора аминокислоты; Сmin - минимальный из скоров незаменимых аминокислот исследуемого белка по отношению к эталону, %.
Биологическую ценность (БЦ) пищевого белка (%) определяют по формуле:
БЦ = 100 – КРАС
Рассчитайте биологическую ценность нескольких видов продуктов питания:
Дата выполнения ________ Балл ____ Подпись преподавателя ____________ Занятие № 20. «Белковый обмен (часть 2)»
Цель занятия: изучить метаболизм аминокислот. ВОПРОСЫ К КОНТРОЛЬНОЙ РАБОТЕ: 1. Механизм реакций трансаминирования. Биологическая роль данного процесса. 2. Пути декарбоксилирования аминокислот. Биологическое значение конечных продуктов этих реакций 3. Дезаминирование аминокислот. Биологическое значение конечных продуктов этих реакций. 4. Роль ароматических аминокислот в метаболизме. 5. Роль серосодержащих аминокислот в метаболизме. Дата выполнения ________ Балл ____ Подпись преподавателя ____________ Экспериментальная работа. Опыт 1. Расщепление белка под действием щелочи.
Приборы. 1. Штатив с пробирками. 2. Набор пипеток. 3. Газовая горелка. 4. Держатель для пробирок. Реактивы. 1. Яичный белок, 30%-ный раствор. 2. Желатин, 30%-ный раствор. 3. Гидроксид натрия или калия, 30%-ный раствор. 4. Ацетат свинца, 10%-ный раствор.
1. В пробирку налейте 1-2 мл 30%-ного раствора яичного белка. 2. Добавьте двойной объем концентрированного раствора щелочи и кипятите смесь в течение 2-3 мин. При этом выпадает осадок (иногда незначительный), растворяющийся при дальнейшем кипячении, и выделяется аммиак. 3. К полученному горячему сильнощелочному раствору добавьте 1 мл раствора ацетата свинца и снова кипятите смесь; образующийся сначала белый осадок гидроксида свинца растворяется в избытке щелочи. Если белок при действии щелочи отщепляет серу, то образуется сульфид свинца, в результате чего прозрачная жидкость постепенно окрашивается в коричневый цвет; при относительно высоком содержании отщепляемой серы выпадает темно-коричневый или черный осадок сульфида свинца. 4. Повторите пункт 1-3 с раствором желатина.
Объясните полученные результаты и наблюдавшиеся эффекты.
Опыт 2. Количественное определение активности аланинаминотрансферазы (АлАТ) в сыворотке крови. Аминотрансферазы или трансаминазы катализируют межмолекулярный перенос аминогруппы с аминокислот на кетокислоты. АлАТ катализирует реакцию переаминирования между аланином и a-кетоглутаровой кислотой. По количеству образовавшейся пировиноградной кислоты можно судить об активности фермента. Количество пировиноградной кислоты определяется колориметрическим путем по цветной реакции с 2,4-динитрофенилгидразином, при которой развивается красно-бурое окрашивание.
1. В две пробирки внесите реактивы согласно следующей таблице:
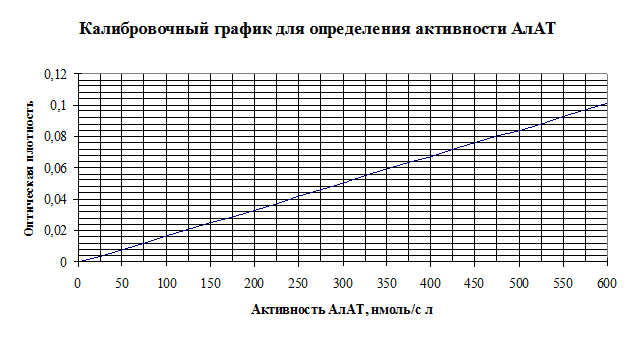
2. Перемешайте и через 10 минут измерьте оптическую плотность пробы против контрольной пробы при длине волны 540 нм, кювета с толщиной слоя 5 мм. 3. Активность АлАТ в опытной пробе определите по калибровочному графику в нмоль/с×л.
Сравните полученный результат с физиологическими величинами и сделайте вывод. Опишите механизм работы кофермента трансаминаз.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|