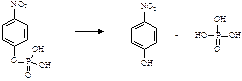|
|
Опыт 2. Изучение активности каталазы крови иммобилизованной на активированном угле.Данная работа является простейшим способом доказательства того, что ферменты после иммобилизации, при соответствующих условиях среды, не теряют свою каталитическую активность. Приборы. 1. Штатив с пробирками. 2. Набор пипеток. 3. Центрифуга. 4. Ступки. Реактивы. 1. Уголь активированный, таблетки. 2. Кровь. 3. Физраствор. 4. Перекись водорода, 3%-ный раствор. Реактивы, оборудования: таблетки активированного угля, свежевзятая кровь, физиологический раствор, 2%-й раствор перекиси водорода, ступки, центрифуга.
1. Возьмите 2 таблетки активированного угля и разотрите их в ступках. 2. В одну из ступок добавьте 3 капли крови и еще раз разотрите. 3. После 10 минутной адсорбции фермента эритроцитов крови на активированном угле перенесите содержимое обеих ступок в центрифужные пробирки. 4. В обе пробирки добавьте по 2 мл физиологического раствора, перемешайте и центрифугируйте в течение 5 минут при 1000 об/мин. 5. После этого выньте пробирки из центрифуги, слейте надосадочную жидкость. 6. В осадок добавьте примерно по 1 мл раствора перекиси водорода. 7. Объясните полученные результаты.
Практическое задание Фосфатазы - ферменты, катализирующие гидролиз фосфорных эфиров. В частности, их субстратом является пара-нитрофенилфосфат (пНФФ):
Образующийся в результате реакции паранитрофенол в щелочной среде имеет желтую окраску. По интенсивности окраски раствора определяют количество образовавшегося продукта реакции. Используя эти данные, рассчитывают скорость ферментативной реакции.
a) Используя табличные данные, постройте график зависимости скорости ферментативной реакции, катализируемой фосфатазой, от концентрации субстрата.
Определите КМ и Vmax.
б) На основании данных о скорости ферментативной реакции при различных значениях рН, представленных в таблице, постройте график зависимости скорости ферментативной реакции от рН.
Определите рН-оптимум фосфатазы. ____________________________________________________________________________________________________________________________________ в) Постройте график зависимости скорости ферментативной реакции от температуры. Данные о скорости ферментативной реакции при различных значениях температуры представлены в таблице.
Определите температурный оптимум фосфатазы. ___________________________________________________________________________________________________________________________________ __________________________________________________________________
г) Конкурентным ингибитором фосфатаз является фосфат. Постройте графики зависимости скорости ферментативной реакции от концентрации субстрата в отсутствие и в присутствии фосфата. Данные представлены в таблице.
Определите КМ и Vmax ферментативной реакции в присутствии и в отсутствие конкурентного ингибитора. Сделайте вывод, каким образом фосфат влияет на эти показатели.
д) Фторид является неконкурентным ингибитором фосфатаз. Постройте графики зависимости скорости ферментативной реакции от концентрации субстрата в отсутствие и в присутствии фторида. Данные представлены в таблице.
Определите КМ и Vmax ферментативной реакции в присутствии и в отсутствие конкурентного ингибитора. Сделайте вывод, каким образом фторид влияет на эти показатели. Дата выполнения ________ Балл ____ Подпись преподавателя ____________
Занятие № 8. «Роль витаминов в метаболизме» Цель занятия:изучить химические свойства некоторых витаминов, лежащих в основе их биологического действия.
Вопросы к контрольной работе: 1. Витамины: классификация и номенклатура. Гипо-, гипер- и авитаминозы. Причины недостаточности витаминов в организме. 2. Коферментные функции водорастворимых витаминов. 3. Биохимические функции витамина А. 4. Биохимические функции витамина Д. 5. Биохимические функции витамина Е. 6. Витаминоподобные соединения. Провитамины.
Дата выполнения ________ Балл ____ Подпись преподавателя ____________ Экспериментальная работа.
Опыт 1. Качественная реакция на витамин А.
Приборы. 1. Штатив с пробирками. 2. Набор пипеток.
Реактивы. 1. Масляный раствор витамина А. 2. Концентрированная серная кислота. 3. Хлороформ. 4. Растительное масло.
1. В пробирку налейте 3 капли масляного раствора витамина А. 2. Добавьте 1 каплю концентрированной серной кислоты.
Объясните, почему в первой пробирке появляется сине-фиолетовое окрашивание? Какими клиническими признаками выражается недостаток витамина А в организме? Как это связано с его биохимическими функциями?

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|