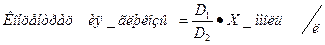|
|
Занятие № 13. «Обмен углеводов (часть 1)»
Цель занятия: рассмотреть факторы, влияющие на переваривание углеводов; освоить метод количественного определения глюкозы в крови.
ВОПРОСЫ К КОНТРОЛЬНОЙ РАБОТЕ: 1. Основные углеводы пищи, их характеристика. Биологическая роль и функции углеводов в организме. 2. Переваривание углеводов в желудочно-кишечном тракте у моногастричных животных. Ферменты, участвующие в переваривании углеводов. Нарушения переваривания углеводов. 3. Особенности переваривания углеводов у жвачных животных. Пути включения летучих жирных кислот (ЛЖК) в метаболизм. 4. Метаболизм глюкозо-6-фосфата. 5. Регуляция содержания глюкозы в крови. Биологическая значимость данного явления. 6. Синтез и распад гликогена: последовательность стадий и биологическое значение этих процессов.
Дата выполнения ________ Балл ____ Подпись преподавателя ____________
Экспериментальная работа. Опыт 1. Влияние формальдегида на активность амилазы.
Приборы. 1. Штатив с пробирками. 2. Набор пипеток. 3. Водяная баня. Реактивы. 1. Крахмал, 1%-ный раствор. 2. Амилаза, раствор. 3. Йод, 1%-ный раствор. 4. Формальдегид, 5%-ный раствор.
1. Возьмите две пробирки. 2. В опытную пробирку налейте по 1 мл растворов крахмала, амилазы и 5 капель 5%-ного формальдегида. 3. В контрольную пробирку налейте по 1 мл раствора крахмала, амилазы и воды. 4. Поместите пробирки на 10 минут в водяную баню при 37°С. 5. В обе пробирки добавьте по 1 капле 1%-ного раствора йода.
Объясните полученные результаты.
Опыт 2. Определение концентрации глюкозы в биологических жидкостях ортотолуидиновым методом. Для определения глюкозы в биологических жидкостях по данному методу в настоящее время различными фирмами выпускаются наборы реактивов. Поэтому суть работы сводится только к правильному использованию набора реактивов согласно инструкции по применению. Глюкоза с ортотолуидином в кислой среде при повышенной температуре образует комплексное соединение сине-зеленого цвета. Интенсивность окраски раствора пропорциональна концентрации глюкозы в исследуемой пробе. Определение без депротеинирования. Без осаждения белков анализируют сыворотку и плазму крови, мочу. Мочу перед анализом разбавляют дистиллированной водой в соотношении от 1:10 до 1:500 и в последующем результат умножают на степень разведения.
1. Приготовьте опытную, калибровочную и контрольную пробы по схеме:
2. Перемешайте. Закройте пробирки фольгой. 3. Поместите пробирки в кипящую водяную баню точно на 8 минут. 4. Охладите пробирку под струей холодной воды. 5. Измерьте оптическую плотность опытной (D1) и калибровочной (D2) проб против холостой пробы при длине волны 620 нм в кювете с толщиной поглощающего слоя 5 мм.
Рассчитайте концентрацию глюкозы по формуле:
где Х - концентрация глюкозы в калибровочном растворе.
Сравните полученные величины с нормальными значениями. Сделайте вывод о состоянии животного. В случае отклонения полученных значений от нормальных величин, предложите возможные причины, объясняющие данный результат.
Назовите факторы, вызывающие гипогликемию и гипергликемию в крови животных.
Опыт 3. Обнаружение сахара в моче с помощью качественной пробы Троммера. Появление сахара в моче наблюдается при бешенстве, нервной форме чумы собак, нарушениях функции печени, панкреатической железы и др. У лошадей глюкозурия встречается реже, чем у собак. Лактозурия наблюдается при родильном парезе, воспалении вымени, закупорке сосудов, маститах.
Приборы. 1. Штатив с пробирками. 2. Набор пипеток. 3. Держатель для пробирок. 4. Газовая горелка. Реактивы. 1. Моча. 2. Гидроксид натрия, 10%-ный раствор. 3. Сульфат меди, 2%-ный раствор.
1. В пробирку налейте 3 мл мочи и 1 мл 10%-ного раствора гидроксида натрия. 2. Осторожно, по каплям, добавляйте 2%-ный раствор сульфата меди до появления небольшой, неисчезающей при взбалтывании голубой мути гидроксида меди (II). 3. Верхний слой жидкости нагрейте до кипения (не кипятите!). 4. В течение 1 минуты (не дольше!) оцените цвет осадка. Образование желто-красного осадка свидетельствует о наличии сахара в моче. (Изменение цвета без осадка может быть при наличии муцина, мочевой кислоты и др.).
Сделайте вывод по результатам эксперимента.
Опыт 4. Полуколичественное определение глюкозы в моче.
Приборы. 1. Ступка с пестиком. 2. Весы. 3. Предметное стекло. 4. Газовая горелка. 5. Пипетка. Реактивы. 1. Моча. 2. Сульфат меди, кристаллический. 3. Карбонат натрия, кристаллический.
1. В ступке разотрите в тонкий порошок 1 г сульфата меди и 10 г карбоната натрия. 2. На предметное стекло насыпьте немного порошка и нанесите несколько капель мочи. 3. Подогрейте до кипения. Синий цвет означает, что глюкозы нет, желтовато-зеленый означает, что глюкозы не более 0,5 %, зеленый – не более 1%, коричнево-красный – до 2%, интенсивно красный – свыше 2%.
Запишите Ваши результаты. Сравните результаты с предыдущим опытом.
Дата выполнения ________ Балл ____ Подпись преподавателя ____________ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|