Скорость гомогенных химических реакций
Скорость химической реакции  принято выражать количеством принято выражать количеством
(моль)  одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени  в единице реакционного пространства. Для гомогенной химической реакции: в единице реакционного пространства. Для гомогенной химической реакции:
 (1) (1)
где  - реакционный объем. - реакционный объем.
Скорость химической реакции может быть измерена по любому компоненту, участвующему в реакции; она всегда положительна, поэтому знак перед производной  должен определяться тем, должен определяться тем,
является ли вещество J исходным реагентом (тогда  отрицательна) или продуктом (тогда отрицательна) или продуктом (тогда  положительна). Иногда нельзя определенно сказать, является ли вещество J реагентом или продуктом. Например, при протекании последовательных реакций положительна). Иногда нельзя определенно сказать, является ли вещество J реагентом или продуктом. Например, при протекании последовательных реакций
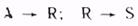
вещество R является продуктом по отношению к первой стадии и реагентом по отношению ко второй. В том случае, если реакция протекает при постоянном объеме, скорость определяют как изменение молярной концентрации cj в единицу времени:
 (2) (2)
Зависимость скорости химических реакций
от концентрации реагентов; кинетические уравнения
Скорость химического превращения зависит от большого числа переменных. На скорость влияют не только факторы, определяющие состояние химического равновесия (температура, давление, состав реакционной системы), но и иные причины, такие, как наличие или отсутствие посторонних веществ, не претерпевающих изменений в результате реакции, условия физический транспортировки реагентов к реакционным центрам и др.
Факторы, оказывающие влияние на скорость химического превращения, обычно подразделяют на две группы: чисто кинетические (микрокинетические), определяющие скорость взаимодействия на молекулярном уровне, и макрокинетические, определяющие влияние на скорость реакции условий транспорта реагентов к зоне реакции, наличия или отсутствия перемешивания, геометрических размеров реактора.
Рассмотрим сначала влияние микрокинетических факторов на скорость химических реакций.
Законы химической кинетики основаны на двух простых принципах (постулатах), впервые установленных при изучении реакций в растворах:
-скорость химической реакции пропорциональна концентрациям реагентов
-суммарная скорость нескольких последовательных превращений, широко различающихся по скорости, определяется скоростью наиболее медленной стадии.
Функциональная зависимость скорости химической реакции от концентраций компонентов реакционной смеси
 (3.6) называется кинетическим уравнением реакции. (3.6) называется кинетическим уравнением реакции.
В химической кинетике принято делить химические реакции на элементарные и неэлементарные (сложные).
-Элементарными (одностадийными) называются реакции, осуществление которых связано с преодолением одного энергетического барьера при переходе из одного состояния реакционной системы в другое. Кинетическое уравнение необратимой элементарной реакции
 (I) (I)
в соответствии с первым постулатом, основанном на законе действующих масс, имеет вид  Коэффициент пропорциональности Коэффициент пропорциональности  , входящий в кинетическое уравнение (3.7), называют константой скорости химической реакции. Целочисленные показатели степени а и в у концентраций реагентов А и В в кинетическом уравнении для элементарной реакции называются порядками реакции по реагентам А и В соответственно. Их сумма а + в = n называется общим порядком реакции. Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим стехиометрическим коэффициентам в уравнении реакции. , входящий в кинетическое уравнение (3.7), называют константой скорости химической реакции. Целочисленные показатели степени а и в у концентраций реагентов А и В в кинетическом уравнении для элементарной реакции называются порядками реакции по реагентам А и В соответственно. Их сумма а + в = n называется общим порядком реакции. Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим стехиометрическим коэффициентам в уравнении реакции.
Наряду с понятием «порядок реакции» в химической кинетике используют понятие «молекулярность реакции». Молекулярность реакции равна минимальному числу молекул, одновременно принимающих участие в одном элементарном акте реакции.
Для элементарных реакций порядок равен молекулярности и может иметь значения 1, 2, 3. Порядок (или молекулярность) элементарных реакций не превышает значения 3, так как вероятность одновременного столкновения более чем трех молекул чрезвычайно низка. Большинство элементарных реакций — это реакции второго порядка.
Однако большинство химических реакций являются сложными. Стехиометрическое уравнение сложной реакции отражает лишь начальное и конечное состояние реакции и не описывает ее механизм. Сложную реакцию иногда удобно рассматривать как формально простую:
 , а ее кинетическое уравнение: , а ее кинетическое уравнение:  . В таких реакциях порядок и молекулярность не совпадают. . В таких реакциях порядок и молекулярность не совпадают.
Способы изменения скорости простых и сложных реакций
Как уже указывалось, скорость химической реакции зависит от большого числа различных факторов. Из кинетических уравнений следует, прежде всего, что скорость простой реакции пропорциональна концентрациям веществ, являющихся реагентами в данной реакции. Следовательно, для простых реакций увеличение концентрации исходных веществ практически всегда приводит к увеличению скорости (за исключением реакций нулевого порядка, скорость которых не зависит от концентрации).
Если реакция, описываемая стехиометрическим уравнением (1), характеризуется различающимися частными порядками по компонентам А и В, то наибольшее влияние на скорость реакции будет оказывать изменение концентрации реагента, имеющего больший частный порядок. Например, если кинетическое уравнение реакции, в которой участвуют два реагента, имеет вид  , то увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а двухкратное увеличение концентрации реагента В приведет к увеличению скорости лишь в 1,19 раза. , то увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а двухкратное увеличение концентрации реагента В приведет к увеличению скорости лишь в 1,19 раза.
Для сложных реакций, в частности для параллельных, вопрос о выборе концентраций реагентов для управления процессом также не является однозначным.
Экспериментально при изучении кинетики химических реакций было обнаружено, что при увеличении температуры на 10° скорость реакции увеличивается в 2—4 раза. Более строго эта зависимость выражается в виде уравнения Аррениуса:
 (3.13) (3.13)
где  — константа скорости реакции; R — универсальная газовая постоянная; Т — температура; — константа скорости реакции; R — универсальная газовая постоянная; Т — температура;  — предэкспоненциальный множитель; Е — энергия активации реакции. — предэкспоненциальный множитель; Е — энергия активации реакции.
Энергия активации элементарной реакции Е — это минимальный избыток энергии над средней внутренней энергией молекул, необходимый для того, чтобы произошло химическое взаимодействие (энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое).
Для обратимых реакций разность энергий активации прямой (Е1 и обратной (Е2) реакций равна тепловому эффекту реакции.
Предэкспоненциальный множитель  учитывает число соударений, вероятность распада активированного комплекса реакции на исходные реагенты без образования продуктов реакции, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры. учитывает число соударений, вероятность распада активированного комплекса реакции на исходные реагенты без образования продуктов реакции, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры.
Из уравнения Аррениуса видно, что принципиально возможен еще один путь управления скоростью- изменение величины Е. Если изменить путь реакции направив ее к конечным продуктам через промежуточные соединения то можно изменить и значение Е. такой путь возможен при применении катализаторов.
7. Гетерогенные процессы. Гетерогенные некаталитические процессы в системе «газ – твердое вещество», «газ – жидкость».
Наиболее часто из гетерогенных реакций используется реакция, протекающая в системах «газ–твердое тело» (Г–Т), а также «газ–жидкость» (Г–Ж), «жидкость–жидкость (Ж–Ж), «твердое тело–твердое тело» (Т–Т), «жидкость–твердое тело» (Ж–Т). Особым классом гетерогенных процессов являются каталитические. Гетерогенный процесс в отличие от гомогенного протекает на границе раздела фаз, а при наличии инертного слоя или золы внутри твердой фазы химическая реакция будет одной из стадий ХТП.
Гетерогенный процесс включает пять стадий:
- внешнюю диффузию реагента через пограничный слой газа;
- внутреннюю диффузию реагента через слой золы или инерта;
- химическую реакцию;
- внутреннюю диффузию продуктов через слой золы или инерта;
- внешнюю диффузию продуктов через пограничный газовый слой.
Каждая стадия протекает со своей скоростью, причем процесс, протекающий с минимальной скоростью, будет лимитировать суммарную скорость гетерогенного процесса.
Скорость ХТП выражается уравнением:  , (5.1) , (5.1)
Наиболее медленными стадиями, каждая из которых может тормозить весь процесс, являются:
- химическая реакция;
- диффузия;
- одновременно химическая реакция и диффузия.
Известно, что при увеличении температуры на 10 0С скорость процесса возрастает в 2-4 раза, в то время как коэффициент диффузии возрастает всегда лишь на 5…10 %, следовательно, определяя скорость гетерогенного ХТП в зависимости от температуры, можно определить лимитирующую стадию.
Если 1/R<1/R1, то лимитирующей стадией является внутренняя диффузия.
Рассмотрим гетерогенную реакцию А(г)+В(тв)=R(тв) (частицы сферические) для трех случаев.
1. Процесс лимитируется внешней диффузией:
 или или  (5.2) (5.2)
Зависимость степени превращения реагента В от отношения  n является прямолинейной. n является прямолинейной.
Для интенсификации такого процесса (для уменьшения значения τ) необходимо:
- уменьшать размер твердой фазы (R0 стоит в числителе);
- увеличивать коэффициент массоотдачи (использовать перемешивание и увеличить скорость потока);
- увеличивать концентрацию СА(г) в газовой фазе.
2. Процесс лимитируется внутренней диффузией:
 или или  , (5.3) , (5.3)
Относительная скорость такого процесса выше скорости процесса, протекающего в области внешней диффузии.
Для интенсификации такого процесса необходимо:
- создавать условия, ускоряющие диффузию, т.е. вводить в систему вещества, увеличивающие порозность инертного слоя или золы;
- увеличивать концентрацию СА(г) в газовой фазе.
3. Процесс лимитируется скоростью химической реакции:
 , ,  или или 
Если процесс лимитируется скоростью химической реакции, то кривая зависимость степени превращения от величины τ / τп похожа на кривую внутренней диффузии, разница мала и сопоставима с ошибками эксперимента.
Для интенсификации такого процесса необходимо:
- уменьшать размер частиц R0;
- увеличивать константу химической реакции путем повышения температуры;
- увеличивать концентрацию СА в газовой фазе.
Полученные зависимости ХВ=f(  n) позволяют определить область протекания процесса. Для этого проводят ряд опытов, строят зависимости и сравнивают с теоретическими кривыми. n) позволяют определить область протекания процесса. Для этого проводят ряд опытов, строят зависимости и сравнивают с теоретическими кривыми.
Закономерности, отражающие процессы, протекающие в системах «газ–жидкость» (Г–Ж) и «жидкость–жидкость» (Ж–Ж), аналогичны, поэтому будем рассматривать только процессы в системах Г–Ж.
Основные стадии:
- диффузия реагента А из турбулентного потока газа через пограничный слой газа II к поверхности раздела фаз I;
- диффузия реагента А от поверхности раздела фаз I в объем пограничного слоя жидкости III;
- диффузия активного компонента В из турбулентного потока жидкости через пограничный слой III в зону реакции VI;
- химическая реакция в пограничном слое жидкости;
- диффузия продукта R из пограничного слоя жидкости III в турбулентный поток жидкости V.
8. Промышленный катализ.
90 % химических реакций являются каталитическими. Под катализом понимают изменение скорости при применении катализатора.Катализ может быть положительным и отрицательным.Если катализ отрицательный, то вещества называют ингибиторами.Катализатор применяют в трех агрегатных состояниях, в основном применяют твердый катализатор (производство серной кислоты, синтез аммиака, производство азотной кислоты и т.д.); жидкие катализаторы применяются при осуществлении ХТП в жидкой среде; применение газообразных катализаторов очень редко.В характеристике реакции всегда указывается каталитическая она или нет. Применение катализатора, кроме очевидных плюсов, с технологической точки зрения имеет следующие недостатки:
- выделение катализатора, если реакция гомогенно-каталитическая;
- применение очистки продуктов от каталитической пыли.
Существует большое количество теорий, объясняющих действие катализатора. Наибольшее распространение получила теория промежуточных состояний, согласно которой химическая реакция между реагентами заменяется на две или более реакции реагентов с катализаторами, когда образуются непрочные химические соединения между реагентами и катализаторами. Ускоряющее действие катализатора заключается в понижении энергии активации химической реакции.
Для характеристики каталитического процесса используют следующие показатели:
- активность. Это отношение константы химической реакции с использованием катализатора к константе химической реакции без катализатора А= kK/k;
- температуру зажигания катализатора. Это та минимальная температура реакционной смеси, при которой процесс протекает с приемлемой для промышленности скоростью. Чем выше активность катализатора, тем меньше температура зажигания. Чем меньше температура зажигания, тем меньше расходы на нагрев реакционной смеси и тем больше температурный диапазон для регулировки температуры. Это особенно важно при протекании обратимых экзотермических реакций (рисунок 7.1);
- селективность. Это избирательность, следовательно, катализатор должен ускорять целевую реакцию, не влияя на побочные взаимодействия;
- отравляемость катализатора (обратимая и необратимая). Если из контактного аппарата убрать каталитические яды, и активность катализатора восстановится, то имеет место обратимое отравление.
Если каталитические яды из контактного аппарата были удалены, а активность катализатора не восстановилась, то катализатор был необратимо отравлен. Отравление катализатора может быть полным и частичным;
Для уменьшения стоимости катализатора и увеличения поверхности контакта фаз используется контактная масса.
Контактная масса состоит: из трегера (носителя) – твердого пористого вещества, на которое тем или иным методом нанесены катализатор и активатор; активаторов – веществ, ускоряющих действие самого катализатора.
По сравнению с гетерогенным процессом появились стадии III, IV, V. Катализаторы и контактная масса применяются в виде сеток, гранул, таблеток и колец.Подготовка контактной массы включает следующие стадии:
- осаждение гидроокисей и карбонатов на носителе с последующим формованием и прокаливанием;
- пропитку носителя растворами катализатора и активатора;
- сплавление веществ;
- совместное прессование всех компонентов с вяжущими веществами.
9. Классификация химических реакторов и режимов их работы.
Не нашли, что искали? Воспользуйтесь поиском по сайту:
©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 принято выражать количеством
принято выражать количеством одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени
одного из реагентов или продуктов, прореагировавшим (или образовавшимся) в единицу времени  в единице реакционного пространства. Для гомогенной химической реакции:
в единице реакционного пространства. Для гомогенной химической реакции: (1)
(1) - реакционный объем.
- реакционный объем. должен определяться тем,
должен определяться тем, отрицательна) или продуктом (тогда
отрицательна) или продуктом (тогда  положительна). Иногда нельзя определенно сказать, является ли вещество J реагентом или продуктом. Например, при протекании последовательных реакций
положительна). Иногда нельзя определенно сказать, является ли вещество J реагентом или продуктом. Например, при протекании последовательных реакций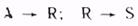
 (2)
(2) (3.6) называется кинетическим уравнением реакции.
(3.6) называется кинетическим уравнением реакции. (I)
(I) Коэффициент пропорциональности
Коэффициент пропорциональности  , входящий в кинетическое уравнение (3.7), называют константой скорости химической реакции. Целочисленные показатели степени а и в у концентраций реагентов А и В в кинетическом уравнении для элементарной реакции называются порядками реакции по реагентам А и В соответственно. Их сумма а + в = n называется общим порядком реакции. Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим стехиометрическим коэффициентам в уравнении реакции.
, входящий в кинетическое уравнение (3.7), называют константой скорости химической реакции. Целочисленные показатели степени а и в у концентраций реагентов А и В в кинетическом уравнении для элементарной реакции называются порядками реакции по реагентам А и В соответственно. Их сумма а + в = n называется общим порядком реакции. Для элементарных реакций частные порядки (порядки реакций по отдельным реагентам) равны соответствующим стехиометрическим коэффициентам в уравнении реакции. , а ее кинетическое уравнение:
, а ее кинетическое уравнение:  . В таких реакциях порядок и молекулярность не совпадают.
. В таких реакциях порядок и молекулярность не совпадают. , то увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а двухкратное увеличение концентрации реагента В приведет к увеличению скорости лишь в 1,19 раза.
, то увеличение концентрации реагента А в 2 раза вызовет рост скорости в 4 раза, а двухкратное увеличение концентрации реагента В приведет к увеличению скорости лишь в 1,19 раза. (3.13)
(3.13) — константа скорости реакции; R — универсальная газовая постоянная; Т — температура;
— константа скорости реакции; R — универсальная газовая постоянная; Т — температура;  — предэкспоненциальный множитель; Е — энергия активации реакции.
— предэкспоненциальный множитель; Е — энергия активации реакции. учитывает число соударений, вероятность распада активированного комплекса реакции на исходные реагенты без образования продуктов реакции, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры.
учитывает число соударений, вероятность распада активированного комплекса реакции на исходные реагенты без образования продуктов реакции, пространственную ориентацию молекул реагентов, а также ряд других факторов, влияющих на скорость реакции и не зависящих от температуры. , (5.1)
, (5.1) или
или  (5.2)
(5.2) n является прямолинейной.
n является прямолинейной. или
или  , (5.3)
, (5.3) ,
,  или
или 