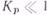|
|
Равновесие химических реакцийПод воздействием подвода или отвода энергии в форме теплоты или работы происходит изменение состояния термодинамической системы (значений термодинамических параметров), называемое термодинамическим процессом. Процессы, представляющие собой непрерывный ряд равновесных состояний, называют равновесным и. При этом равновесным считают состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты. Устойчивое равновесие характеризуется следующими общими условиями: 1) неизменностью равновесного состояния системы во времени при постоянных внешних условиях. 2)подвижностью равновесия (самопроизвольным восстановлением состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия); 3) динамическим характером равновесия, т. е. установлением и сохранением равновесия вследствие равенства скоростей прямого и обратного процессов; 4) возможностью подхода к. состоянию равновесия с двух противоположных сторон; 5) минимальным значением энергии Гиббса в изобарно-изотермических и энергии Гельмгольца F а изохорно-изотермических процессах (dG= 0. d2G > 0; df= 0, d2F > 0). Из этих общих условий выводятся конкретные условия для химического равновесия. Химические реакции, как правило, обратимы. По мере протекания процесса скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается; в какой-то момент времени скорости прямой и обратной реакций становятся равными — наступает состояние химического равновесия. Химическое равновесие характеризуется неизменностью числа молекул веществ, составляющих химическую систему, при неизменных внешних условиях. Так как условием равновесия при постоянных Т и Р служит минимум энергии Гиббса (dG = 0), то в условиях химического равновесия должно также соблюдаться равенство
где Известно, что химическим потенциалом называется величина
Большая положительная величина Закон действующих масс. Пусть дана гомогенная реакция:
скорость прямой реакции пропорциональна произведению концентраций реагентов А и В:
а скорость обратной реакции — произведению концентраций продуктов R и S:
Отношение констант скоростей, называемое константой равновесия, обозначим через Кс, получаем выражение закона действующих масс:
Как следует из выражения (1), константа равновесия не зависит от концентрации, так как изменение концентрации одного из участников реакции вызовет такие изменения концентрации всех остальных веществ, что Кс сохранит свое числовое значение. Таким образом, основное значение закона действующих масс состоит в том, что он устанавливает связь между равновесными концентрациями всех реагирующих веществ. При анализе реакций, протекающих в газовой фазе, константу равновесия выражают через парциальные давления:
Стандартная энергия Гиббса при данной температуре: Уравнение (3) называется уравнением изотермы Вант-Го ффа. Оно в общем виде связывает между собой энергию Гиббса и константу равновесия, которую можно вычислить, зная где 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (2.1)
(2.1) - химический потенциал компонента
- химический потенциал компонента  :
:  — количество компонента
— количество компонента  (моль).
(моль).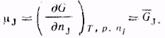
 указывает на высокую реакционную способность частиц.
указывает на высокую реакционную способность частиц.
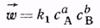

 (1)
(1)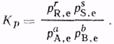 (2)
(2) (3)
(3) G°. Значения стандартных энергий Гиббса образования многих тысяч химических соединений сведены в таблицы термодинамических свойств и приведены в справочной литературе. В случае отсутствия табличных значений
G°. Значения стандартных энергий Гиббса образования многих тысяч химических соединений сведены в таблицы термодинамических свойств и приведены в справочной литературе. В случае отсутствия табличных значений  их рассчитывают, используя уравнение
их рассчитывают, используя уравнение 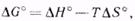 (4)
(4) — стандартные энтальпия и энтропия. Значения этих стандартных термодинамических величин также приводятся в справочной литературе. Порядок и знак величины
— стандартные энтальпия и энтропия. Значения этих стандартных термодинамических величин также приводятся в справочной литературе. Порядок и знак величины  позволяют качественно предвидеть положение равновесия реакции. Если
позволяют качественно предвидеть положение равновесия реакции. Если  , равновесие сдвинуто вправо, выход продукта велик, а константа равновесия имеет большое числовое значение. Если
, равновесие сдвинуто вправо, выход продукта велик, а константа равновесия имеет большое числовое значение. Если  , равновесие сдвинуто влево, выход продукта мал
, равновесие сдвинуто влево, выход продукта мал