|
Классификация химических реакций, лежащих в основе промышленных химико-технологических процессов
В современной химии известно большое число различных химических реакций. Многие из них осуществляются в промышленных химических реакторах и, следовательно, становятся объектом изучения химической технологии.
В зависимости от того, какие признаки взяты при этом за основу, существует несколько видов классификации химических реакций. В химической технологии можно применять различные виды классификации химических реакций.
Для выбора конструкции химического реактора и способов управления проведением процесса существенное значение имеет фазовый состав реакционной системы. В зависимости от фазового состава реагентов и продуктов различают гомогенные и гетерогенные химические реакции.
В случае гомогенных реакций реагенты и продукты находятся в одной фазе (жидкой или газообразной). Например, окисление оксида азота кислородом воздуха в производстве азотной кислоты — газофазная реакция, а реакции этерификации (получение эфиров из органических кислот и спиртов) — жидкофазные.
При протекании гетерогенных реакций, по меньшей мере, один из реагентов или продуктов находится в фазовом состоянии, отличающемся от фазового состояния остальных участников реакции. Различают двухфазные системы «газ — жидкость», «газ — твердое вещество», «жидкость — твердое вещество», «жидкость — жидкость» (две несмешивающиеся жидкости), «твердое — твердое» и различные варианты трехфазных реакционных систем.
Другим важным видом классификации является классификация по механизму осуществления реакции. Различают простые (одностадийные) и сложные (многостадийные) реакции, в частности параллельные, последовательные и последовательно-параллельные реакции.
Простыми называют реакции, для осуществления которых требуется преодоление лишь одного энергетического барьера (одна стадия).
Сложные реакции включают в себя несколько параллельных или последовательных стадий (простых реакции).
Реальные одностадийные реакции встречаются чрезвычайно редко. Однако некоторые сложные реакции, проходящие через ряд промежуточных стадий, удобно считать формально простыми. Это возможно в тех случаях, когда промежуточные продукты реакции в условиях рассматриваемой задачи не обнаруживаются.
Классификация реакций по молекулярности учитывает, сколько молекул участвует в элементарном акте реакции; различают моно – би - и тримолекулярные реакции. Вид кинетического уравнения (зависимости скорости реакции от концентраций реагентов) позволяет классифицировать реакции по порядку. Порядком реакции называется сумма показателей степеней у концентраций реагентов
в кинетическом уравнении. Существуют реакции первого, второго, третьего, дробного порядков.
В зависимости от того, применяются или не применяются для изменения скорости реакции специальные вещества — катализаторы, различают каталитические и некаталитические реакции и соответственно химико-технологические процессы. Подавляющее большинство химических реакций, на которых основаны промышленные химико-технологические процессы, — это каталитические реакции.
Химические реакции различают также по тепловому эффекту. При протекании экзотермических реакций, сопровождающихся выделением теплоты (Q > 0), происходит уменьшение энтальпии реакционной системы (  ); при протекании эндотермических реакций, сопровождающихся поглощением теплоты (Q<0), происходит увеличение энтальпии, реакционной системы ( ); при протекании эндотермических реакций, сопровождающихся поглощением теплоты (Q<0), происходит увеличение энтальпии, реакционной системы ( 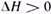 ). ).
3. Технологические критерии эффективности химического процесса: степень превращения, выход продукта, селективность, производительность, мощность, интенсивность, время контактирования, объемная скорость.
3. Степень превращения – это доля исходного реагента, использованного на химическую реакцию.
Степень превращения реагента показывает, насколько полно в ХТП используется сырье.
Возьмем произвольно в качестве участника реакции вещество Ј, следовательно, степень превращения: 
nJ,0 – количество реагента J в исходной реакционной смеси;
nJ – количество реагента J в исходной реакционной смеси, выходящей из реактора;
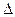 nJ – изменение количества реагента J в ходе химической реакции. nJ – изменение количества реагента J в ходе химической реакции.
Чаще всего в химической реакции участвуют несколько реагентов, следовательно, для каждого из них можно определить степень превращения. Рассмотрим простую необратимую реакцию aA + bB = = rR + sS.
Степень превращения реагентов А и В:
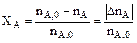 ; ; 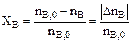 . .
Если 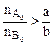 , т.е. реагент А взят в избытке по отношению к реагенту В, то ХА < ХВ. , т.е. реагент А взят в избытке по отношению к реагенту В, то ХА < ХВ.
Если 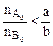 , т.е. реагент B взят в избытке по отношению к реагенту A, то ХА > ХВ. , т.е. реагент B взят в избытке по отношению к реагенту A, то ХА > ХВ.
Выход продукта – это отношение реально полученного количества продукта к максимально возможному его количеству, которое могло бы быть получено при данных условиях проведения химической реакции.  , Из определения следует, что , Из определения следует, что 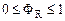 .Выход продукта зависит от типа реакции. .Выход продукта зависит от типа реакции.
Рассмотрим простую необратимую реакцию aA + bB = rR + sS.
Максимально возможное количество продукта R в такой реакции будет получено, если весь реагент А (nA,0) вступит в реакцию nRmax = r/a nA,0. Следовательно,  ; ;  ,т.е. выход продукта и степень превращения совпадают. ,т.е. выход продукта и степень превращения совпадают.
Рассмотрим простую обратимую реакцию aA + bB  rR + sS rR + sS
Для такой реакции максимально возможное количество продукта R определяется как равновесное количество продукта R при данных условиях осуществления реакции (температура, давление, соотношение начальных концентраций реагентов). Отсюда
 ; ; 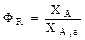 . .
Таким образом, для обратимых реакций выход продукта равен доле, которую составляет реально достигаемая степень превращения от равновесной для данных условий проведения реакции
Рассмотрим параллельные и последовательные реакции:
a1A + b1B = rR + sS (целевая реакция);a2A + b2B = xX + yY (побочная реакция).
Максимально возможное количество продукта R будет получено в том случае, если весь исходный реагент А будет расходоваться на целевую реакцию 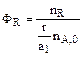 . Таким образом, для сложных реакций . Таким образом, для сложных реакций 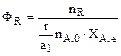 . .
Полная или интегральная селективность φ – это отношение количества исходного реагента, пошедшего на целевую реакцию, к количеству реагента, пошедшего на целевую реакцию и побочное взаимодействие: 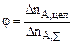 , ,
 – количество реагента А, пошедшего на целевую реакцию – количество реагента А, пошедшего на целевую реакцию
 – количество реагента А, пошедшего на целевую реакцию и побочное взаимодействие. – количество реагента А, пошедшего на целевую реакцию и побочное взаимодействие.
По определению  . .
Для необратимой реакции выход продукта будет равен : 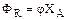 . .
А для обратимой реакции:  . .
Мгновенная, или дифференциальная, селективность φ' – это отношение скорости расходования реагента на целевую реакцию к скорости расходования реагента на целевую реакцию и побочное взаимодействие 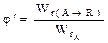 , ,
 – скорость расходования реагента А на целевую реакциюя – скорость расходования реагента А на целевую реакциюя
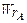 – скорость расходования реагента А (на целевую реакцию и побочное взаимодействие).По определению 0 – скорость расходования реагента А (на целевую реакцию и побочное взаимодействие).По определению 0 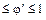 .эффективности целевой реакции по сравнению с побочными взаимодействиями. .эффективности целевой реакции по сравнению с побочными взаимодействиями.
Производительность – это количество продукции, полученное в единицу времени:
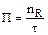 ; ;  , ,
СR – концентрация продукта;
υ – объемный расход реакционной смеси.
Мощность – максимальная производительность аппарата, машины, ХТС: P = Пmax
Интенсивность – это производительность аппарата, отнесенная к какой-либо величине, характеризующей размеры аппарата (объему, площади поперечного сечения и т.д.): I = П/А .
А – «живое» сечение аппарата.
Интенсивность позволяет сравнивать различные аппараты для проведения одного и того же ХТП.
Время контактирования (соприкосновения) – отношение свободного объема катализатора к объемному расходу реакционной смеси:
 , , 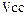 – свободный объем катализатора; υ – объемный расход реакционной смеси. – свободный объем катализатора; υ – объемный расход реакционной смеси.
На практике чаще всего пользуются фиктивным временем контактирования: 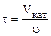 , Vкат – объем слоя катализатора. , Vкат – объем слоя катализатора.
Объемная скорость – это величина, обратная 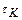 , и представляет собой , и представляет собой 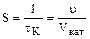 . Объемная скорость – это объемный расход, приходящийся на единицу объема катализатора.Влияние времени контактирования (объемной скорости) однотипно для многих каталитических реакций. С увеличением времени . Объемная скорость – это объемный расход, приходящийся на единицу объема катализатора.Влияние времени контактирования (объемной скорости) однотипно для многих каталитических реакций. С увеличением времени 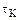 выход продукта простой каталитической реакции растет. выход продукта простой каталитической реакции растет.
4. Равновесие химических реакций. Способы смещения равновесия химических реакций.
Не нашли, что искали? Воспользуйтесь поиском по сайту:
©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 ); при протекании эндотермических реакций, сопровождающихся поглощением теплоты (Q<0), происходит увеличение энтальпии, реакционной системы (
); при протекании эндотермических реакций, сопровождающихся поглощением теплоты (Q<0), происходит увеличение энтальпии, реакционной системы ( 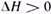 ).
).
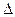 nJ – изменение количества реагента J в ходе химической реакции.
nJ – изменение количества реагента J в ходе химической реакции.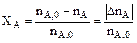 ;
; 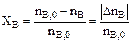 .
. 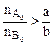 , т.е. реагент А взят в избытке по отношению к реагенту В, то ХА < ХВ.
, т.е. реагент А взят в избытке по отношению к реагенту В, то ХА < ХВ.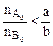 , т.е. реагент B взят в избытке по отношению к реагенту A, то ХА > ХВ.
, т.е. реагент B взят в избытке по отношению к реагенту A, то ХА > ХВ. , Из определения следует, что
, Из определения следует, что 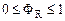 .Выход продукта зависит от типа реакции.
.Выход продукта зависит от типа реакции. ;
;  ,т.е. выход продукта и степень превращения совпадают.
,т.е. выход продукта и степень превращения совпадают. rR + sS
rR + sS ;
; 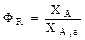 .
. 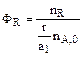 . Таким образом, для сложных реакций
. Таким образом, для сложных реакций 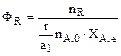 .
. 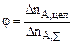 ,
,  – количество реагента А, пошедшего на целевую реакцию
– количество реагента А, пошедшего на целевую реакцию – количество реагента А, пошедшего на целевую реакцию и побочное взаимодействие.
– количество реагента А, пошедшего на целевую реакцию и побочное взаимодействие. .
.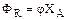 .
.  .
. 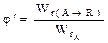 ,
,  – скорость расходования реагента А на целевую реакциюя
– скорость расходования реагента А на целевую реакциюя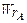 – скорость расходования реагента А (на целевую реакцию и побочное взаимодействие).По определению 0
– скорость расходования реагента А (на целевую реакцию и побочное взаимодействие).По определению 0 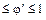 .эффективности целевой реакции по сравнению с побочными взаимодействиями.
.эффективности целевой реакции по сравнению с побочными взаимодействиями. 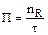 ;
;  ,
,  ,
, 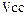 – свободный объем катализатора; υ – объемный расход реакционной смеси.
– свободный объем катализатора; υ – объемный расход реакционной смеси.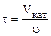 , Vкат – объем слоя катализатора.
, Vкат – объем слоя катализатора.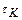 , и представляет собой
, и представляет собой 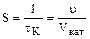 . Объемная скорость – это объемный расход, приходящийся на единицу объема катализатора.Влияние времени контактирования (объемной скорости) однотипно для многих каталитических реакций. С увеличением времени
. Объемная скорость – это объемный расход, приходящийся на единицу объема катализатора.Влияние времени контактирования (объемной скорости) однотипно для многих каталитических реакций. С увеличением времени 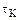 выход продукта простой каталитической реакции растет.
выход продукта простой каталитической реакции растет.