Ионно-молекулярные уравнения
Задание 1. Напишите уравнения диссоциации и константы диссоциации для слабых электролитов.
Задание 2. По заданным ионным уравнениям напишите соответствующие молекулярные уравнения.
Задание 3. Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений.
| № п/п
| Задание 1
| Задание 2
| Задание 3
| |
| Sn(OH)2,
CoCl2
| Cr3+ + OH– + 2Cl– = CrOHCl2
| NaOH→NaHSO3→Na2SO3→NaCl
|
|
| Al(OH)3,
HCN
| Be2+ + 4OH– =  + 2H2O + 2H2O
| Na2HPO4→Na3PO4→NaH2PO4→Na2HPO4
| |
| Zn(OH)2, H3AsO4
| Ni2+ + OH– + Cl– = NiOHCl
| NaHSO3→Na2SO3→H2SO3→NaHSO3
| |
| Be(OH)2,
HF
| Fe2+ + Cl– + OH– = FeOHCl
| NaHTe→Na2Te→Na2SO4→NaCl
| |
| Bi(OH)3,
Zn(OH)2
| Cd2+ + OH– + Br– = CdOHBr
| NaHSe→Na2Se→NaBr→AgBr
| |
| Ni(CH3COO)2,
Al(OH)3
| Zn2+ + 4OH– =  + 2H2O + 2H2O
| NaHS→H2S→K2S→KBr
| |
| Fe(NO3)3,
Be(OH)2
| H++ 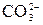 = = 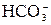
| Na3PO4→Na2HPO4→H3PO4→K2HPO4
| |
| H2SiO3,
Zn(OH)2
| 2H++ 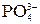 = = 
| (SnOH)2SO4→SnSO4→Sn(OH)2→Na2SnO2
| |
| ZnCl2,
Cr(OH)3
| NiOHCl + H+ = Ni2+ + H2O + Cl–
| BaBr2→ BaCO3→ H2CO3→NaHCO3
| |
| H2Te,
Al(OH)3
| Co2+ + OH– + Cl– = CoOHCl
| [Cr(OH)2]2SO4→CrOHSO4→ Cr2(SO4)3→ Cr(OH)3
| |
| Cr2(SO4)3,
Al(OH)3
| FeOHCl + H+ = Fe2+ + H2O + Cl–
| (NH4)2SO4→NH4OH→NH4Br→NH4NO3
| |
| Cr(OH)3,
HF
| Cu2+ + OH– + Cl– = CuOHCl
| FeOHSO4→Fe2(SO4)3→Fe(OH)3→FeCl3
| |
| Na2CO3,
Be(OH)2
| Al3+ + OH– + 2Cl– = AlOHCl2
| Al(OH)3→AlCl3→ Al(OH)3→KAlO2
| |
| HI,
Sn(OH)2
| Cr3+ + OH– + 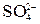 = CrOHSO4 = CrOHSO4
| Al2(SO4)3→[Al(OH)2]2SO4→ Al(OH)3→NaAlO2
| |
| BaBr2,
Zn(OH)2
| Al3+ +OH– + 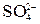 = AlOHSO4 = AlOHSO4
| Cr2(SO4)3→[Cr(OH)2]2SO4→ Cr(OH)3→NaCrO2
| |
| H2Se,
Cr(OH)3
| Be2+ + 4OH– =  + 2H2O + 2H2O
| AlOHSO4→Al2(SO4)3→Al(OH)3→AlCl3
| |
| CoCl2,
Al(OH)3
| Cd2+ + OH– + Br– = CdOHBr
| Fe(OH)3→FeCl3→ Fe(OH)3→KFeO2
| |
| HCN,
Cr(OH)3
| 2H++ 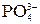 = = 
| Cr2(SO4)3→[Cr(OH)2]2SO4→ Cr(OH)3→NaCrO2
| |
| Al(NO3)3,
Be(OH)2
| Co2+ + OH– + Cl– = CoOHCl
| (PbOH)2SO4→PbSO4→Pb(OH)2→Na2PbO2
| |
| Na2S,
Zn(OH)2
| Cu2+ + OH– + Cl– = CuOHCl
| K2HPO4→K3PO4→KH2PO4→K2HPO4
|
ГИДРОЛИЗ СОЛЕЙ
Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды.
Гидролиз является обратимым процессом. В реакциях гидролиза участвуют ионы слабых электролитов: катионы слабых оснований и анионы слабых кислот. Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O ↔ H+ + OH–; в результате среда становится либо кислой (рН < 7), либо щелочной (рН > 7).
1) Соль, образованная сильным основанием и слабой кислотой,подвергается гидролизу по аниону. Реакция среды щелочная (рН > 7).
Na2CO3 + HOH ↔ NaHCO3 + NaOH
Первая ступень гидролиза: 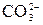 + HOH ↔ + HOH ↔ 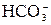 + OH– + OH–
2) Соль, образованная слабым основанием и сильной кислотой,подвергается гидролизу по катиону. Реакция среды кислая (рН < 7).
Cu(NO3)2 + HOH ↔ CuOHNO3 + HNO3
Cu2+ + HOH ↔ CuOH+ + H+
3) Соль, образованная слабым основанием и слабой кислотой,подвергается гидролизу по катиону и аниону. Характер среды определяется константами диссоциации образовавшихся слабых электролитов.
CH3COONH4 + HOH ↔ CH3COOH + NH4OH
CH3COO– +  + HOH ↔ CH3COOH + NH4OH + HOH ↔ CH3COOH + NH4OH
4) При совместном гидролизе двух солейобразуется слабое основание и слабая кислота:
2 FeCl3 + 3Na2S + 6 H2O = 2Fe(OH)3↓ + 3H2S↑ + 6 NaCl
2 Fe3 + + 2S2– + 6 H2O = 2Fe(OH)3↓ + 3H2S↑
5) Соль, образованная сильным основанием и сильной кислотой,гидролизу не подвергается, реакция среды нейтральная:
KNO3 + HOH ≠
Ионы К+ и 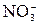 не образуют с водой слабодиссоциирующих продуктов (КОН и НNО3 – сильные электролиты). не образуют с водой слабодиссоциирующих продуктов (КОН и НNО3 – сильные электролиты).
Задания к разделу Гидролиз солей
Задание 1. Написать уравнения гидролиза солей в молекулярной и ионной формах, указать рН растворов (рН > 7, рН < 7 или рН » 7).
Задание 2. Написать уравнения реакций, протекающих между веществами в водных растворах
| № п/п
| Задание 1
| Задание 2
| |
| BeCl2; Na2SO3
| K2SiO3 + (NH4)2SO4; AlBr3 + Na2SO3
| |
| K2S; FeSO4
| SnBr2 + K2CO3; Na2SO3 + SnCl2
| |
| Na2S; CrBr3
| FeCl3 + Na2CO3; Na2CO3 + Al2(SO4)3
| |
| Be(NO3)2; KCN
| CrBr3 + K2S; BeCl2 + Na2SiO3
| |
| NiSO4; Al2(SO4)3
| K2SiO3 + BeBr2; K2S + Cr2(SO4)3
| |
| NaCN; Mn(NO3)2
| Na2CO3 + Fe2(SO4)3; K2SiO3 + Bi(NO3)3
| |
| CoCl2; K2CO3
| CrBr3 + K2CO3; Na2CO3 + Cr(NO3)3
| |
| CdBr2; SnBr2
| NH4Cl + K2SiO3; SnSO4 + Na2SO3
| |
| BaS; CuSO4
| K2SO3 + Cr2(SO4)3; K2SO3 + Al(NO3)3
| |
| KHCO3; Na2SiO3
| SnCl2 + Na2CO3; AlBr3 + Na2CO3
| |
| Cr(NO3)3; K2HPO4
| K2SO3 + CrCl3; BeCl2 + Na2SiO3
| |
| CuCl2; ZnSO4
| K2S + Al(NO3)3; Na2CO3 + Cr(NO3)3
| |
| K2PO4; NiCl2
| AlCl3 + K2SO3; NH4Cl + K2SiO3
| |
| FeCl3; Ba(CH3COO)2
| Na2S + AlBr3; FeCl3 + Na2CO3
| |
| NaHS; ZnSO4
| K2S + Be(NO3)2; AlBr3 + Na2SO3
| |
| Na2S; K2CO3
| FeBr2 + Na2CO3; K2SiO3 + (NH4)2SO4
| |
| KHCO3; Na2SO3
| K2S + BeSO4; K2SiO3 + BeBr2
| |
| CdBr2; Al2(SO4)3
| NH4Br + Na2SiO3; Na2CO3 + Fe2(SO4)3
| |
| Be(NO3)2; K2HPO4
| Na2SO3 + SnCl2; NH4Cl + K2SiO3
| |
| NiSO4; CrBr3
| BeBr2 + BaS; SnCl2 + Na2CO3
|
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Не нашли, что искали? Воспользуйтесь поиском по сайту:
©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|


 + 2H2O
+ 2H2O
 + 2H2O
+ 2H2O
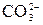 =
= 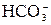
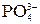 =
= 
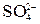 = CrOHSO4
= CrOHSO4
 + HOH ↔ CH3COOH + NH4OH
+ HOH ↔ CH3COOH + NH4OH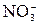 не образуют с водой слабодиссоциирующих продуктов (КОН и НNО3 – сильные электролиты).
не образуют с водой слабодиссоциирующих продуктов (КОН и НNО3 – сильные электролиты).