
|
|
Стандартные энтальпия образования, энтропия и энергия Гиббса образования веществ
1. (ΔН0298)х.р. = 2 2. (ΔS 0298)х.р. = 2 = 175,6 · 10-3 кДж/моль > 0. Прямая реакция сопровождается увеличением энтропии, беспорядок в системе увеличивается – благоприятный фактор для протекания химической реакции в прямом направлении. 3. Рассчитываем стандартную энергию Гиббса реакции двумя способами. При выполнении задания можно считать только одним способом «а»: а) по закону Гесса: (ΔG 0298)х.р. = 2 б) по уравнению (2): (ΔG 0298)х.р. = 172,5 – 298 · 175,6 · 10-3 = 172,5 – 52,3 = 120,2 кДж > 0. Оказалось, что (ΔН0298)х.р. > (ΔS 0298)х.р.·Т и тогда (ΔG 0298)х.р. > 0, т.е. при стандартных условиях энтальпийный фактор сыграл решающую роль. Таким образом, прямая реакция при стандартных условиях самопроизвольно протекать не может. Может протекать обратная реакция. В данных условиях в системе преобладают процессы агрегации по сравнению с процессами дегазации частиц, т.е. упорядоченность системы возрастает (из двух молей газообразного вещества получается 1 моль газа и 1 моль твердого вещества). 4. Обратите внимание: если ΔН0 выражено в кДж, то и ΔS 0 должно быть в кДж/К.
5. По уравнению (4): (ΔG 02000)х.р. ≈ ΔН0298 – 2000·ΔS 0298 ≈ ≈ 172,5 – 2000·175,6·10-3 ≈ - 178,7 кДж < 0. Т.е. при 2000 К: ΔS 0х.р.·Т > ΔН0х.р. Энтропийный фактор стал решающим, самопроизвольное протекание прямой реакции стало возможно: из одного моля газа и 1 моля твердого вещества образуется 2 моля газа. 6. lg К298 = -21,1; К298 ≈ 10-21 << 1. Система далека от состояния истинного химического равновесия, в ней преобладают исходные вещества.
Зависимость ΔG 0 от температуры для реакции СО2(г) + С(графит) ↔ 2 СО(г).
7. lg К2000 = 4,8·104 >> 1 – система также далека от состояния равновесия, при этой температуре в ней преобладают продукты реакции. 8. СО2(г) + С(графит) ↔ 2 СО(г), ΔН0 > 0
По принципу Ле Шателье при повышении температуры равновесие должно смещаться в сторону прямой реакции, константа равновесия должна увеличиваться. 9. Рассмотрим, как согласуются наши расчетные данные с принципом Ле Шателье. Представим некоторые данные, показывающие зависимость энергии Гиббса и константы равновесия указанной реакции от температуры:
Таким образом, полученные расчетные данные соответствуют нашим выводам, сделанным на основании принципа Ле Шателье.
Задания к разделу Термодинамика химических процессов
При решении задач этого раздела пользуйтесь таблицей 1 приложения. Для указанной реакции а) рассчитать стандартную энтальпию и энтропию; б) объяснить, какой из факторов: энтропийный или энтальпийный способствует самопроизвольному протеканию реакции в прямом направлении; в) в каком направлении (прямом или обратном) будет протекать реакция при 298К и 1000К; г) рассчитать температуру, при которой равновероятны оба процесса; д) назвать все способы увеличения концентрации продуктов равновесной смеси. е) построить график зависимости ΔGр (кДж) от Т (К)
ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Кинетика – учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакции является неравенство ΔGр, Т < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, Н2(Г) + ½ О2(Г) = Н2О(Г) (1) 2Al(К) + 3 I2(К) = 2 AlI3(К) (2) Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины для первой и воды для второй). Катализатор как бы снимает кинетический «тормоз», и тогда проявляется термодинамическая природа вещества. Скорость химических реакций зависит от многих факторов, основные из которых – концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе. Пример. Константа равновесия гомогенной системы СО(г) + Н2О(г) ↔ СО2(г) + Н2(г) при 850ºС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей есть тоже величина постоянная и называется константой равновесия данной системы: υпр = К1 [СО][Н2О]; υобр = К2 [СО2][Н2]; Кравн = В условии задачи даны исходные концентрации, тогда как в выражение Кравн входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]равн = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут: [СО2]равн = [Н2]равн = х моль/л; [СО]равн = (3 – х) моль/л; [Н2О]равн = (2 – х) моль/л. Зная константу равновесия, находим значение, а затем и исходные концентрации всех веществ:
х2 = 6 – 2х – 3х + х2; 3х = 6; х = 1,2 моль/л. Таким образом, искомые равновесные концентрации: [СО2]равн = 1,2 моль/л; [Н2]равн = 1,2 моль/л; [СО2]равн = 3 – 1,2 = 1,8 моль/л; [Н2О]равн = 2 – 1,2 = 0,8 моль/л. Задания к разделу Элементы химической кинетики, Химическое равновесие Равновесие в системе:
установилось при следующих концентрациях: [В ]и [С],моль/л. Определить исходную концентрацию вещества [В]0 и константу равновесия, если исходная концентрация вещества А равна [А]0 моль/л

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
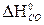 –
–  = 2 (-110,5) + 393,5 = 172,5 кДж > 0 - эндотермическая реакция – неблагоприятный фактор для протекания химической реакции, особенно при низких температурах.
= 2 (-110,5) + 393,5 = 172,5 кДж > 0 - эндотермическая реакция – неблагоприятный фактор для протекания химической реакции, особенно при низких температурах.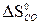 –
– 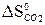 –
– 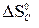 = 2 · 197,5 – 213,7 – 5,7 = 175,6 Дж/К =
= 2 · 197,5 – 213,7 – 5,7 = 175,6 Дж/К = –
– 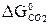 = 2 (-137,1) + 394,4 = 120,2 кДж > 0;
= 2 (-137,1) + 394,4 = 120,2 кДж > 0; ≈
≈  ≈ 982 К.
≈ 982 К.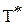 ≈ 982 К – ориентировочная температура, при которой устанавливается истинное химическое равновесие, выше этой температуры прямая реакция может протекать самопроизвольно.
≈ 982 К – ориентировочная температура, при которой устанавливается истинное химическое равновесие, выше этой температуры прямая реакция может протекать самопроизвольно. ;
;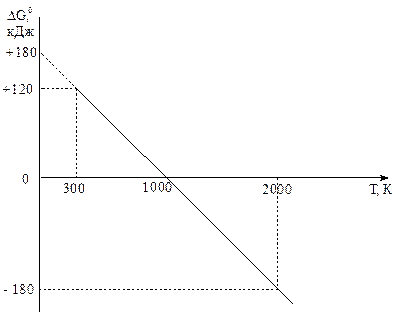
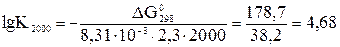

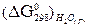 = - 228,59 кДж/моль, а
= - 228,59 кДж/моль, а 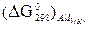 = - 313,8 кДж/моль и, следовательно, при Т = 298 К и р = 1 атм возможны реакции, идущие по уравнениям:
= - 313,8 кДж/моль и, следовательно, при Т = 298 К и р = 1 атм возможны реакции, идущие по уравнениям: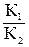 =
=  .
. ;
;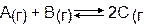 )
)