
|
|
СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
Разбавленные растворы неэлектролитов обладают рядом свойств (коллигативные свойства), количественное выражение которых зависит только от числа находящихся в растворе частиц растворенного вещества и от количества растворителя. Некоторые коллигативные свойства растворов используются для определения молекулярной массы растворенного вещества. Зависимость этих свойств от концентрации выражается уравнениями: 1. Понижение давления пара растворителя над раствором, Δр (закон Рауля) р1 = N1p0; Δр = p0 – p1 = N2p0 = p0 Здесь p1 – парциальное давление насыщенного пара растворителя над раствором; p0 – давление насыщенного пара над чистым растворителем; N1 – мольная доля растворителя; N2 – мольная доля растворенного вещества; n1 – количество растворителя; n2 – количество растворенного вещества. 2. Понижение температуры кристаллизации раствора, Δtкрист Δtкрист = K·m. Здесь К – криоскопическая постоянная растворителя; m – моляльная концентрация растворенного вещества. 3. Повышение температуры кипения раствора, Δtкип Δtкип = Е·m. Здесь Е – эбуллиоскопическая постоянная растворителя. 4. Осмотическое давление, Р, кПа P = CмRT. Здесь Cм – молярная концентрация; R – газовая постоянная [8,31 Дж/(моль·К)]; Т – температура, К. Задания к разделу Свойства разбавленных растворов неэлектролитов* * - при решении задач этого раздела использовать данные таблицы 2 приложения. 101. Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная температуру кристаллизации раствора (–0,930С). 102. Вычислите процентную концентрацию водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,390С. 103. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,20С. 104. Вычислите процентную концентрацию водного раствора метанола СН3ОН, температура кристаллизации которого –2,790С. 105. Чему равно давление насыщенного пара над 10%-ным водным раствором карбамида CO(NH2)2 при температуре 1000С. 106. При какой приблизительно температуре будет кипеть 50%-ный (по массе) водный раствор сахарозы С12Н22О11? 107. При какой приблизительно температуре будет кристаллизоваться 40%-ный (по массе) водный раствор этилового спирта С2Н5ОН? 108. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при – 200С? 109. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (ρ = 0,8 г/мл). При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет? 110. Водно-спиртовый раствор, содержащий 15% спирта (ρ = 0,97 г/мл), кристаллизуется при –10,260С. Найти молекулярную массу спирта и осмотическое давление раствора при 293 К. 111. Температура кипения водного раствора сахарозы С12Н22О11 равна 101,40С. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор? 112. При какой температуре будет кристаллизоваться 14,6%-ный водный раствор сахара С12Н22О11? 113. Определить температуру кипения водного раствора глицерина с концентрацией 6,45%. 114. Раствор нафталина в бензоле кипит при температуре 81,250С. Температура кипения бензола 80,20С. Определить массовую долю нафталина в растворе. 115. Водный раствор метанола имеет концентрацию растворенного вещества 4,85%. При какой температуре будет кристаллизоваться данный раствор? 116. Водный раствор сахарозы С12Н22О11 кипит при 1010С. Какова массовая доля сахарозы в растворе? 117. Водный раствор этилового спирта кристаллизуется при температуре –270С. Какова процентная концентрация (по массе) этого раствора? 118. Смешаны вода и этиловый спирт в массовом соотношении 2:1. При какой температуре будет кристаллизоваться этот раствор? 119. Какой объем метилового спирта (ρ = 0,8 г/мл) нужно добавить к 9 л воды, чтобы полученный раствор не замерзал до –80С? 120. Определить температуру кристаллизации водно-спиртового раствора, плотность которого ρ = 0,97 г/мл, содержащего 15% спирта с относительной молекулярной массой 32.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ Электролитами называют вещества, растворы и расплавы которых проводят электрический ток. К электролитам относятся неорганические кислоты, а также основания, амфотерные гидроксиды и соли. Они распадаются в водных растворах и расплавах на катионы (Kn+) и анионы (Am-). Процесс распада молекул электролитов на ионы в среде растворителя получил название электролитической диссоциации (или ионизации). Для количественной характеристики силы электролита используют понятие степени электролитической диссоциации (ионизации) – α, которая равна отношению числа молекул, распавшихся на ионы (n), к общему числу молекул электролита, введенных в раствор (N): α = n / N. Таким образом, α выражают в долях единицы. По степени диссоциации электролиты условно подразделяют на сильные (α ≈ 1) и слабые (α < 1). Сильные электролиты 1) Соли (средние, кислые: Al2(SO4)3, NaHCO3 2) Неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI, HClO4 и др. 3) Гидроксиды щелочных и щелочноземельных металлов: KOH, NaOH, Ca(OH)2, Ba(OH)2 и др. Сильные электролиты диссоциируют в водном растворе практически нацело: Al2(SO4)3 = 2Al3+ + 3 HNO3 = Н+ + Ba(OH)2 = Ba2+ + 2ОН–
Слабые электролиты 1) Почти все органические кислоты: СН3СООН, Н2С2О4 и др. 2) Некоторые неорганические кислоты: Н2СО3, H2S, HCN, H2SiO3, HNO2, H2SO3, H3PO4 и др. 3) Гидроксиды металлов основного характера (кроме щелочных и щелочноземельных) и гидроксид аммония NH4OH. 4) Амфотерные гидроксиды: Al(OH)3, Zn(OH)2, Cr(OH)3, Sn(OH)2, Pb(OH)2 и др. Для слабых электролитов диссоциация – обратимый процесс, для которого справедливы общие законы равновесия. Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации (ионизации) – Кд: СН3СООН ↔ СН3СОО– + Н+
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, и каждую ступень равновесного состояния характеризует своя константа диссоциации (причем Кд1 всегда больше Кд2 и т.д), например, при диссоциации H2S:1-я ступень H2S ↔ Н+ + HS–, Кд1 = 2-я ступень HS– ↔ Н+ + S2–, Кд2 = где [ ] – равновесные концентрации ионов и молекул. Диссоциация Cu(OH)2:1-я ступень Cu(OH)2 ↔ Cu(ОН)+ + ОН– 2-я ступень Cu(ОН)+ ↔ Cu2+ + ОН– Амфотерные гидроксиды, например Pb(OH)2, диссоциируют по основному типу: Pb(OH)2↔ PbOH+ + OH– PbOH+ ↔ Pb2+ + OH– и кислотному: H2PbO2 ↔ H+ +
В растворах электролитов реакции протекают между ионами. Для записи ионных реакций применяют ионные уравнения. При составлении ионных уравнений реакции все слабые электролиты, газы и труднорастворимые электролиты записывают в молекулярной форме, все сильные электролиты (кроме труднорастворимых солей) в ионной форме. Примеры составления ионных уравнений реакций: - образование труднорастворимых соединений: Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3 Pb2+ + 2I- = PbI2↓ - реакции с участием слабодиссоциирующих соединений: CH3COONa + HCl = CH3COOH + NaCl CH3COO- + H+ = CH3COOH
HCl + NaOH = NaCl + H2O H+ + OH- = H2O
HCl + NH4OH = NH4Cl + H2O H+ + NH4OH =
CH3COOH + NH4OH = CH3COONH4 + H2O CH3COOH + NH4OH = CH3COO- + - образование газообразных веществ: Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
Пример 1.Осуществить превращения NaOH → NaHSO3 → Na2SO3. Решение.NaOH + H2SO3 = NaHSO3 + H2O OH- + H2SO3 = NaHSO3 + NaOH = Na2SO3 + H2O
Пример 2.Осуществить превращения Ni(OH)2 → (NiOH)2SO4 → NiSO4 Решение.2Ni(OH)2 + H2SO4 = (NiOH)2SO4 + H2O 2Ni(OH)2 + 2H+ +
(NiOH)2SO4 + H2SO4 = 2NiSO4 + 2H2O (NiOH)2SO4 +2H+ = 2Ni2+ + 2 Пример 3.По ионным уравнениям реакций составить молекулярные. Ca2+ + CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl Ca(OH)2 + K2CO3 = CaCO3↓ + 2KOH
Cu2+ + OH–= Cu(OH)2↓ CuSO4 + 2NaOH = Cu(OH)2↓ +Na2SO4 CuCl2 + 2KOH=Cu(OH)2↓ + 2KCl
Cu2+ + S2– = CuS↓ CuCl2 + K2S = CuS↓ + 2KCl Cu(NO3)2 + Na2S = CuS↓ + 2NaNO3
Задания к разделу Электролитическая диссоциация. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
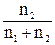
 NaHCO3 = Na+ +
NaHCO3 = Na+ + 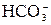
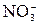 H2SO4 = 2Н+ +
H2SO4 = 2Н+ +  .
. =6·10-8;
=6·10-8;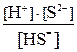 =1·10-14;
=1·10-14;
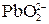
 + H2O
+ H2O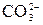 + 2H+ = CO2↑ + H2O
+ 2H+ = CO2↑ + H2O + H2O
+ H2O + H2O
+ H2O