
|
|
Тема 14. Кислородсодержащие органические соединенияСодержание учебного материала: Понятие функциональной группы органических соединений. Их классификация, особенности строения. Спирты. Классификация, номенклатура, изомерия, получение, физические, химические и пожароопасные свойства. Применение. Многоатомные спирты. Простые эфиры. Номенклатура, изомерия, получение, физические, химические и пожароопасные свойства (на примере диэтилового эфира). Применение. Альдегиды и кетоны. Номенклатура, строение, изомерия, получение, физические, химические и пожароопасные свойства. Применение. Карбоновые кислоты и их производные. Предельные и непредельные одноосновные кислоты. Номенклатура, строение, изомерия, получение, физические, химические и пожароопасные свойства. Применение. Сложные эфиры карбоновых кислот. Номенклатура, строение, изомерия, получение, физические, химические и пожароопасные свойства. Применение. Лабораторная работа № 9. «Кислородсодержащие органические соединения» На самостоятельное изучение выносятся следующие вопросы: Перекисные соединения. Особенности химического строение, изомерия, получения, физические, химические и пожароопасные свойства. Применение. Причины повышенной пожаровзрывоопасности органических пероксидных соединений. Высшие жирные кислоты и высшие спирты. Мыла. Воски, жиры, масла. Применение. Выполнение расчетной работы. Подготовка к лабораторной работе. Подготовка к контрольной работе. Перечень формируемых компетенций: [ОК-4, ОК-8, ОК-14, ПК-2, ПСК-32]. Литература: основная [1, 6-8]; дополнительная [29-32]. Тема 15. Азотсодержащие органические соединения Содержание учебного материала: Нитросоединения, способы получения, химические свойства. Краткая характеристика взрывчатых веществ. Алифатические и ароматические амины. Способы получения и свойства. На самостоятельное изучение выносятся следующие вопросы: Анилин, анилиновые красители. Характеристика диазосоединений и азосоединений. Перечень формируемых компетенций: [ОК-8, ОК-14]. Литература: основная [1, 6-8]; дополнительная [32]. Тема 16. Полимеры и полимерсодержащие материалы Содержание учебного материала: Общие сведения о полимерах и материалах на их основе. Основные понятия химии ВМС. Классификация и номенклатура. Взаимосвязь строения полимеров с их термостойкостью и горючестью. Токсичные продукты разложения и горения полимерных материалов. Химические превращения полимеров. Особенности реакций полимеров. Снижение горючести полимеров. На самостоятельное изучение выносятся следующие вопросы: Химические системы: полимеры, олигомеры и их синтез. Комплементарность. Высокомолекулярные соединения и их роль в природе и технике. Синтез ВМС: реакции полимеризации и реакции поликонденсации. Полимераналогичные превращения. Перечень формируемых компетенций: [ОК-8, ОК-14]. Литература: основная [1, 6-8]; дополнительная [19, 29-32]. Основная литература 1. Глинка Н.Л. Общая химия: Учебное пособие / Н.Л. Глинка. - М.: КНОРУС, 2010.-752с. 2. Глинка Н.Л. Задачи и упражнения по общей химии / Н.Л. Глинка. - М.: Интеграл - пресс, 2004.- 240 с. 3. Угай Я.А. Общая и неорганическая химия: Учеб. для вузов. Изд.4 / Я.А. Угай -М.: Высшая школа, 2004.-527 с 4. Коровин Н.В. Общая химия / Н.В. Коровин.- М., Высшая школа, 2002.-558с. 5. Ахметов Н.С. Общая и неорганическая химия / Н.С.Ахметов. - М., Высшая школа, 2008.-744 с. 6. Артеменко А.И. Органическая химия / А.И.Артеменко.- М., Высшая школа, 2002.-605с. 7. Тюкавкина Н.А. Органическая химия. Кн.1: Основной курс / Н.А. Тюкавкина. -М.: Дрофа, 2003.-640с. 8. Гельфман М.И. Коллоидная химия / М.И. Гельфман.-СПб.: Изд-во «Лань», 2003.-336с. 9. Щукин Е.Д. Коллоидная химия: Учеб. для учебник для университетов и химико-технологических вузов / Е.Д.Щукин, А.В. Перцов, Е.А. Амелина. - М., Высшая школа, 2007.- 444 с. 10. Сумм Б. Д. Основы коллоидной химии. М.: Изд. Центр «Академия», 2006.-240 с. 11. Вольхин В.В. Основной курс. Общая химия: 2-е изд. перераб. доп.- СПб.: Лань, 2008. – 464с.
Дополнительная литература 12. Артеменко А.И. Практикум по органической химии / А.И. Артеменко, И.В. Тикунова, Е.К.Ануфриев. - М., Высшая школа, 2001.-187 с. 13. Некрасов Б.В. Основы общей химии. В двух томах: 4-е изд., стер. – СПб.: Лань, 2003. – 656 (688) с. 14. Коровин Н.В. Лабораторные работы по химии / Н.В. Коровин, Э.И. Мингулина, Н.Г. Рыжова. - М., Высшая школа, 2007. - 256 с. 15. Евтюхов С.А. Лабораторный практикум по общей химии: учебное пособие для курсантов 1 курса очной и заочной форм обучения / С.А. Евтюхов, И.М. Фоминых. – Екатеринбург, Уральский институт ГПС МЧС России, 2005.-140с. 16. Ахметов Н.С. Лабораторные и семинарские занятия по общей и неорганической химии / Н.С.Ахметов, М.К.Азизова, Л.И.Бадыгина. - М., Высшая школа, 1999.-366 с. 17. Химия в действии. В 2-х частях. / М.Фримантл. - Пер. с англ. -М., Мир. 1998.- Ч.1. – 620 с. 18. Химия в действии. В 2-х частях. / М.Фримантл. - Пер. с англ. - М., Мир. 1998.- Ч.2. – 528 с. 19. Драйздейл Д. Введение в динамику пожаров / Д.Драйздейл. - Пер. с англ. - М., Стройиздат, 1990. - 424 с. 20. Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Пономаревой – СПб.: «Иван Федоров», 2002. – 240с. 21. Артеменко А.И. Справочное руководство по химии / А.И.Артеменко, И.В.Тикунова, В.А.Малеванный. - М., Высшая школа, 2002. - 367 с. 22. Вайтнер В.В. Химия. Информационно-справочный материал / В.В. Вайтнер, С.Н. Пазникова, Т.В. Штеба. - Учебно-методическое пособие для курсантов факультета инженеров пожарной безопасности. Специальность 280104.65 – Пожарная безопасность. - Екатеринбург, УрИ ГПС МЧС России, 2007. - 19 с. 23. Вайтнер В.В. Строение атома и периодический закон / В.В. Вайтнер. - Учебно-методическое пособие для курсантов факультета инженеров пожарной безопасности. Специальность 280104.65 – Пожарная безопасность. - Екатеринбург, УрИ ГПС МЧС России, 2007. – 27 с. 24. Вайтнер В.В. Классы неорганических веществ / В.В. Вайтнер, И.М. Фоминых - Учебно-методическое пособие для курсантов факультета инженеров пожарной безопасности. Специальность 280104.65 – Пожарная безопасность. - Екатеринбург, УрИ ГПС МЧС России, 2007. – 20 с. 25. Вайтнер В.В. Основные закономерности протекания химических процессов / В.В. Вайтнер, И.М. Фоминых - Учебно-методическое пособие для курсантов, обучающихся по специальности 280104.65 – Пожарная безопасность. - Екатеринбург, ГОУ ВПО «УрИ ГПС МЧС России», 2008. – 40 с. 26. Вайтнер В.В. Растворы / В.В. Вайтнер, И.М.Фоминых. - Учебно-методическое пособие для курсантов факультета инженеров пожарной безопасности. Специальность 280104.65 – Пожарная безопасность. – Екатеринбург, ГОУ ВПО «УрИ ГПС МЧС России», 2007. - 37 с. 27. Вайтнер В.В. Окислительно-восстановительные реакции / В.В. Вайтнер, С.Н. Пазникова, Т.В. Штеба. - Учебно-методическое пособие для курсантов очного обучения факультета инженеров пожарной безопасности по специальности 280104.65 – Пожарная безопасность. - Екатеринбург, УрИ ГПС МЧС России, 2006. - 23 с. 28. Евтюхов С.А. Коррозия металлов. Электролиз / С.А. Евтюхов, Н.С. Кожевникова, И.М.Фоминых. - Методические указания для самостоятельной работы по химии для курсантов факультета инженеров пожарной безопасности и студентов, обучающихся по специальности 280104.65 – Пожарная безопасность. – Екатеринбург, УрИ ГПС МЧС России, 2008. - 23 с. 29. Евтюхов С.А. Кислородсодержащие органические соединения / С.А.Евтюхов, С.Н. Пазникова, И.М. Фоминых. - Методические указания к расчетным работам по химии для курсантов первого курса, обучающихся по специальности 280104.65 – Пожарная безопасность. – Екатеринбург, УрИ ГПС МЧС России, 2008. - 38 с. 30. Евтюхов С.А. Химия / С.А.Евтюхов, Н.С. Кожевникова. - Методические указания к лабораторным работам для курсантов факультета инженеров пожарной безопасности по специальности 280104.65 – Пожарная безопасность. – Екатеринбург, УрИ ГПС МЧС России, 2008. - 11 с. 31. Вайтнер В.В. Органическая химия. Часть 1, Часть 2 / В.В. Вайтнер, С.Н. Пазникова. - Учебно-методическое пособие по дисциплине химия для курсантов первого курса, обучающихся по специальности 280104.65 - Пожарная безопасность. – Екатеринбург, УрИ ГПС МЧС России, 2008. - Часть 1 - 70 с. Часть 2 - 40 с. 32. Пазникова С.Н., Фоминых И.М. Органическая химия. Сборник задач. – Екатеринбург: УрИ ГПС МЧС России, 2009. - 61 с. 33. Вайтнер В.В. Классификация и химические свойства неорганических веществ / В.В. Вайтнер, Т.В. Якубова - Учебно-методическое пособие. - Екатеринбург, УрИ ГПС МЧС России, 2010. – 25 с.
Таблица вариантов контрольных заданий
КОНТРОЛЬНЫЕ ЗАДАНИЯ СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА Строение атомов 1. Какой элемент имеет в атоме три электрона, для каждого из которых главное квантовое число n = 3 и орбитальное квантовое число l = 1? Чему равны для этих электронов значения магнитного ml и спинового mS квантовых чисел? 2. Валентные электроны атома химического элемента характеризуются следующим набором квантовых чисел n, l, ml и mS соответственно: 5, 0, 0, +1/2; 5, 0, 0, -1/2; 5, 1, 1, +1/2; 5, 1, 0, +1/2. О каком элементе идет речь? Составьте электронную формулу его иона, находящегося в высшей степени окисления. 3. Составьте электронную формулу иона таллия Tl3+. Для валентных электронов атома Tl укажите набор всех четырех квантовых чисел. 4. Напишите полное уравнение ядерной реакции 5. Для элемента Х даны энергии ионизации (кДж·моль-1): I1 = 1402; I2 = 2856; I3 = 4578; I4 = 7475; I5 = 9445; I6 = 53266. В какой группе периодической системы находится элемент Х? Ответ обоснуйте. 6. Для элемента Х получены следующие значения энергий ионизации (кДж·моль-1): I1 = 801; I2 = 2427; I3 = 3660; I4 = 25026; I5 = 32827. Определите наиболее вероятную формулу оксида элемента Х. Выбор обоснуйте. 7. Среди указанных наборов квантовых чисел укажите те, которые корректно определяют орбиталь атома: 1) 2, 1, -1, +1/2; 2) 1, 1, 0, +1/2; 3) 3, 1, -1, +1/2. Ответ обоснуйте. 8. Сколько неспаренных электронов содержат невозбужденные атомы а) B; б) S; в) As; г) Cr; д) Hg; е) Eu? Дайте обоснованный ответ. Составьте электронно-графическую формулу и объясните особую устойчивость иона Fe3+ (по сравнению с ионом Fe2+). 9. У элементов каких периодов электроны внешнего слоя характеризуются значением суммы главного и орбитального квантового чисел n+l = 5? Укажите значения всех квантовых чисел для валентных электронов атома иттрия. 10. Какие из следующих изотопов (их два) неустойчивы: 67Zn, 101Rh, 32Mg, 43Ca, 141La? Ответ поясните. Для неустойчивых изотопов укажите тип и количество частиц, испускание которых приведет к образованию устойчивого изотопа. Какие устойчивые изотопы образуются? 11. Сколько электронов и сколько протонов входит в состав следующих частиц: а) 12. Напишите уравнение реакции образования соединения, в состав которого входят только ионы элементов с конфигурацией внешних электронов 3s23p6. Какова масса всех электронов, содержащихся в 100г этого вещества? (Масса электрона равна 1/1832 а.е.м). 13. Химический элемент имеет в атоме 4 электрона, для каждого из которых главное квантовое число n = 2 и орбитальное квантовое число l = 1. Чему равны для этих электронов значения магнитного ml и спинового mS квантовых чисел? О каком элементе идет речь? 14. Валентные электроны атома химического элемента характеризуются следующим набором квантовых чисел n, l, ml и mS соответственно: 3, 2, 2, +1/2; 4, 0, 0, +1/2; 4, 0, 0, -1/2. О каком элементе идет речь? Составьте электронную формулу его иона, находящегося в высшей степени окисления. 15. Составьте электронную формулу иона In3+. Для валентных электронов атома In укажите набор всех четырех квантовых чисел. 16. Среди указанных наборов квантовых чисел укажите те, которые корректно определяют орбиталь атома: 1) 1, 0, 0, +1/2; 2) 2, 2, 1, -1/2; 3) 2, 1, -1, +1/2. Ответ обоснуйте. 17. Сколько неспаренных электронов содержат невозбужденные атомы а) Fe; б) Kr; в) Te; г) W? Дайте обоснованный ответ. Какие общие свойства имеют элементы Mn и Cl? 18. У элементов каких периодов электроны внешнего слоя характеризуются значением суммы главного и орбитального квантового чисел n+l = 4? Укажите значения всех квантовых чисел для валентных электронов атома кремния. 19. Сколько электронов и сколько протонов входит в состав следующих частиц: а) 20. Химический элемент состоит из двух изотопов. Ядро первого изотопа содержит 10 протонов и 10 нейтронов. В ядре второго изотопа нейтронов на 2 больше. На 9 атомов легкого изотопа приходится один атом более тяжелого изотопа. Вычислите среднюю атомную массу элемента.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 [p, n]? Для валентных электронов атома образовавшегося изотопа укажите набор квантовых чисел.
[p, n]? Для валентных электронов атома образовавшегося изотопа укажите набор квантовых чисел.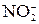 ; б) PH3? Для валентных электронов атома фосфора укажите набор всех четырех квантовых чисел.
; б) PH3? Для валентных электронов атома фосфора укажите набор всех четырех квантовых чисел. ; б) KBr? Для валентных электронов атома серы укажите набор всех четырех квантовых чисел.
; б) KBr? Для валентных электронов атома серы укажите набор всех четырех квантовых чисел.