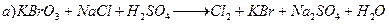|
|
Вычислить рН буферных растворов, полученных при сливаниирастворов: 1. 30 см3 0,05 М H2CO3 и 70 см3 0,15 М Na2CO3. 2. 40 см3 0,05%-ного С6H5COOH и 110 см3 0,1%-ного С6H5COOK. 3. 10 см3 0,02 М HNO3 и 40 см3 0,05 М KNO2. 4. 20 см3 0,15%-ного H2SO3 и 80 см3 0,1%-ного Na2SO3. 5. 60 см3 0,01 М CH3COOH и 40 см3 0,05 М CH3СООК. 6. 150 см3 0,02%-ного CH3CH2COOH и 50 см3 0,1%-ного CH3CH2COOK. 7. 70 см3 0,01 М NH4Cl и 30 см3 0,05 М NH4OH. 8. 170 см3 0,1 М KH2PO4 и 150 см3 0,05 М K2HPO4. 9. 50 см3 0,05%-ного Na2CO3 и 150 см3 0,1%-ного NaHCO3. 10. 130 см3 0,02 М NaH2PO4 и 20 см3 0,05 М Na2HPO4. 11. 80 см3 0,1%-ного Na2SO3 и 120 см3 0,05%-ного H2SO3. 12. 60 см3 0,03 М CH3COOK и 40 см3 0,02 М CH3COOH. 13. 90 см3 0,05%-ного NH4OH и 110 см3 0,1%-ного NH4Br. 14. Сколько см3 0,5%-ного раствора формиата натрия надо добавить к 50 см3 0,1 М раствора муравьиной кислоты, чтобы получить раствор с рН=3,8? 15. Сколько грамм карбоната натрия надо добавить к 50 см3 0,2 М гидрокарбоната натрия, чтобы получить раствор с рН=9,8? 16. Сколько см3 0,4 М раствора нитрата аммония надо добавить к 20 см3 0,15 М раствора аммиака, чтобы получить раствор с рН=9,1? 17. Сколько см3 до добавить к 50 см3 0,25М дигидрофосфата калия, чтобы получить раствор с рН=6,8? 18. Сколько грамм ацетата натрия надо добавить к 150 см3 0,15 М раствора соляной кислоты, чтобы получить раствор с рН=4,3? 19. Сколько грамм хлорида аммония надо добавить к 300 см3 0,15 М раствора аммиака, чтобы получить раствор с рН=5,9? 20. Сколько грамм карбоната натрия надо добавить к 150 см3 0,05 М гидрокарбоната натрия, чтобы получить раствор с рН=5? Задачи и упражнения по теме «Гидролиз солей» 1. Вычислите концентрацию ионов Н+ и рН раствора, полученного путем смешивания 25 мл 0,03 М раствора фтороводородной кислоты (Ка=6,8 10-4) и 40 мл 0,2 М раствора фторида калия. 2. Какова должна быть концентрация формиата калия в 0,02 М растворе муравьиной кислоты, чтобы получить раствор, у которого рН=4,0? 3. Вычислите необходимое отношение ССоли : Скисл для формиатного буфера, чтобы получить раствор, у которого рН=4,0. 4. Рассчитайте соотношение молярных концентраций гидрофосфата натрия и дигидрофосфата натрия в буферном растворе с рН=7,2. 5. Определить рН раствора, полученного в результате смешивания равных объемом 0,12 М СН3СООН и 0,12 М СН3СООК. Как изменится величина рН, если к полученному буферному раствору добавить а) 0,12 М КОН; б) 0,12 М HCl? 6. Рассчитайте, как изменится рН, если к 100 мл 0,1 М аммиачного буферного раствора прибавить 10 мл 0,1 М соляной кислоты. 7. Вычислите рН и рОН раствора, содержащего в 1 л 8,5 г аммиака и 107 г хлорида аммония. 8. Какова должна быть концентрация хлорида аммония в 0,01 н.растворе аммиака (Кв=1,76 10-5), чтобы рН раствора был равен 8? 9. Рассчитайте рН раствора, полученного при смешивании 200 мл 0,01 М раствора фосфата натрия и 100 мл 0,02 М гидрофосфата натрия. 10. Какова должна быть концентрация хлорида аммония в 0,01 н. растворе аммиака, чтобы концентрация ионов Н+ была равной 10-7 моль/л (нейтральный раствор)? Тематика рефератов и контрольных работ. Методические указания к выполнению Перечень тем рефератов 1. История становления и развития аналитической химии как науки. 2. Отбор и подготовка проб к анализу. 3. Методы разделения и концентрирования в аналитической химии. 4. Экстракция как метод выделения, разделения и концентрирования. 5. Диантипирилметаны как экстрагирующие реагенты. 6. Осаждение и соосаждение в аналитической химии. 7. Хроматография как физико-химический метод разделения веществ. 8. Кинетические методы анализа. 9. Биохимические методы анализа. 10. Электрохимические методы анализа. Потенциометрия. 11. Электрохимические методы анализа. Кулонометрия. 12. Электрохимические методы анализа. Вольтамперометрические методы. 13. Электрохимические методы анализа. Кондуктометрия и электрогравиметрия. 14. Спектроскопические методы анализа. 15. Атомно-эмиссионная спектроскопия. 16. Атомно-абсорбционная спектроскопия. Примеры контрольных заданий для 4 семестра Вариант 1 1. Расставить коэффициенты, используя электронно-ионный метод:
2. Навеска K2Cr2O7 0,6813 г растворена в 300 мл воды. Какой объём этого раствора следует взять, чтобы после прибавления к нему избытка KJ на титрование затрачивалось 23,16 мл 0,1 моль/л тиосульфата натрия. Составить уравнения реакций. Вариант 2 1. Расставить коэффициенты, используя электронно-ионный метод:
2. Рассчитать массу гидроксида натрия, содержащегося в растворе, на титрование которого затрачено: а) 15,00 мл раствора серной кислоты с титром 0,006734 г/мл; б) 15,00 мл раствора серной кислоты с титром по гидроксиду натрия 0,006734 г/мл. Вариант 3 1. Сколько % меди в сплаве, если навеска равна 2 г. После растворения раствор перенесли в мерную колбу 500 мл и внесли избыток KJ к 50 мл раствора. На титрование затрачено 38,96 мл 0,05 моль/л раствора тиосульфата натрия. Составить уравнения реакций. 2. Расставить коэффициенты, используя электронно-ионный метод:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|