|
|
НЕКОТОРЫЕ ТЕОРЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ АДСОРБЦИИАдсорбция является разновидностью общего процесса сорбции и представляет собой поглощение поверхностью. При этом поглощаемое вещество называется адсорбатом (или адсорбтивом), поглощающее – адсорбентом. Адсорбция однозначно описывается термодинамическим подходом, ее теория базируется на уравнении Гиббса ds = - Гdm. (49) В (49) s - поверхностное натяжение, характеризующее работу образования единицы поверхности новой фазы; Г – удельная адсорбция, равная количеству моль, г или единиц объема вещества, поглощенных единицей поверхности или массы адсорбента; m - химический потенциал вещества , характеризующий работу, затрачиваемую на поглощение 1 моля адсорбата таким объемом адсорбента, когда концентрации всех остальных поглощенных им компонентов можно считать неизменными. В первом приближении, химический потенциал вещества связан с его концентрацией зависимостью: m = m0 + RTlnC, (50) где m0 – химический потенциал при стандартных условиях. Тогда dm = RTdlnC. Сочетание уравнений (49) и (50) дает ds = - ГRTdlnC или ds = - ГRTdC/С. Откуда Г = - При При И, наконец, в некотором промежуточном случае
Рис. 9. Виды зависимости s от С. 1 – для ПАВ, 2 – для ПНВ, 3 – в случае
Встречаются два вида адсорбции: физическая и химическая. Физическая адсорбция обусловлена физическими силами, прежде всего, межмолекулярным взаимодействием, складывающимся из трех составляющих: 1. Ориентационного. 2. Индукционного. 3. Дисперсионного. Причем последнее, как правило, вносит наибольший вклад. Энергия межмолекулярного взаимодействия невелика и адсорбирующиеся по этому типу вещества, легко десорбируются, в частности, при повышении температуры адсорбента. Химическая адсорбция обусловлена образованием связей, близких по своей природе к химическим (ковалентная, ионная, донорно-акцепторная). Наиболее простой ее случай связан с адсорбцией на энергетически однородной поверхности. В этом варианте энергия адсорбции вещества, а это всегда экзотермический процесс, не зависит от степени заполнения поверхности адсорбента адсорбатом. Рассмотрим случай адсорбции подобного рода, который описывается изотермой адсорбции Ленгмюра, базирующейся на следующих допущениях: - поверхность адсорбента энергетически однородна, т. е. все ее активные центры характеризуются одинаковой адсорбционной способностью; - каждый активный центр поверхности адсорбента может принять только одну частицу адсорбата; - адсорбция носит мономолекулярный характер, т. е. на первом слое адсорбированных частиц не может адсорбироваться второй слой; - адсорбция носит равновесный характер, т. е. в стационарном состоянии количество адсорбирующихся и десорбирующихся частиц на единице поверхности в единицу времени одинаково. Изотерма Ленгмюра имеет вид: в случае адсорбции из жидкой фазы Г = При поглощении дисперсионной среды из газовой Г = где С и Р – соответственно равновесные концентрация или давление адсорбата. Часто последнее уравнение записывают и иначе Г = Г¥ либо Г = Г¥ где Г¥ - предельная (максимально возможная) удельная адсорбция. Уравнение (51а) можно привести к виду
или
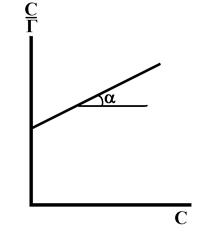
В координатах
Рис. 10. Графический вид зависимости (51в) в координатах
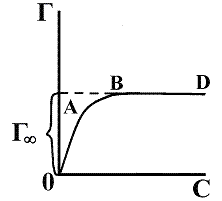
Величина tg a равна 1/k2. Отрезок, отсекаемый на оси ординат – 1/k1k2. Таким образом, константы уравнения Ленгмюра (51а) или (51б) легко могут быть найдены графически. В координатах Г, С уравнение Ленгмюра имеет вид (рис. 11). На кривой рис. 11 можно выделить 3 участка. ОА – проходящий через начало координат, который реализуется при k1С << 1. В этом случае Г = k2k1С. Криволинейный участок АВ реализуется, когда k1С соизмеримо с 1. И отрезок ВГ, параллельный оси абсцисс, наблюдается при k1С >> 1, т. е. когда Г = Г¥.
Рис. 11. Графический вид уравнения (51а) (изотерма Ленгмюра).
АБСОРБЦИЯ Вторая разновидность сорбции – абсорбция представляет собой поглощение вещества объемом. Абсорбция газов основана на способности жидкости растворять вещества в газо- или парообразном состоянии. Абсорбция индивидуальных веществ в этом случае описывается уравнением Генри СГ = kГРГ, где СГ и РГ – соответственно концентрация газа и его равновесное давление над раствором. Константу kГ, зависящую от природы растворяемого вещества, растворителя и температуры, называют постоянной Генри. В случае газовой смеси СГ = kГj, где j - объемная или мольная доля данного газа в смеси. Растворимость газов существенно зависит от их природы и температуры. Некоторые примеры подобного рода приведены в таблице 21. Таблица 21 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
. < 0, величина Г положительна, т. е. адсорбция имеет место. Такие вещества называются поверхностно-активными (ПАВ).
< 0, величина Г положительна, т. е. адсорбция имеет место. Такие вещества называются поверхностно-активными (ПАВ).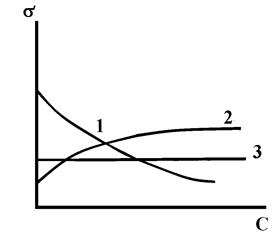
 , (51а)
, (51а) , (51б)
, (51б)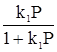
 ,
, =
= 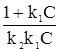
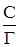 =
=  +
+  . (51в)
. (51в)