
|
|
Фенол и его растворы как ОПРДавление насыщенного пара индивидуального фенола как индивидуального соединения следует рассчитывать также по уравнению (13). Соответствующие константы равны: А = 11,5638, В = 3586,36, С = 273 (они постоянны в области температур от 0 до 400С). Температура плавления и кипения С6Н5ОН равна соответственно 41 и 181,20С. Давление насыщенного пара фенола как функция температуры, рассчитанное по уравнению (13), приведено в таблице 13. Таблица 13 Влияние температуры на давление насыщенного пара фенола
Совершенно очевидно, что продукт, представленный преимущественно фенолом, не попадет в отходы производства. В этом плане наибольший интерес представляют его водные растворы. Вновь, как и в предыдущем случае, оценим давление насыщенного пара фенола в условиях существования его водных растворов, содержащих 1,0 и 10,0 г/л С6Н5ОН. Отметим, что Х где ni и nj – число моль каждого компонента в 1 л раствора. Пусть i–тый компонент – фенол. Тогда при его концентрации 1,0 и 10,0 г/л n1 = 0,0106 и В этом случае мольная доля фенола в рассматриваемых растворах равна: Х С использованием уравнений (8) и (9) получим максимальную концентрацию С6Н5ОН (m, мг/м3) и величину Кпр (таблица 15). Таблица 14
Зависимость давления насыщенного пара фенола (Па) от температуры
*увеличено в 104 раз, ** увеличено в 103 раз.
Таблица 15
Влияние температуры на максимальную концентрацию фенола в атмосферном воздухе над раствором и Кпр.
Проведя подобные расчеты для широкого интервала концентраций любого токсичного компонента с шагом заданного размера, можно представить их в виде номограмм, из которых легко оценить область допустимых концентраций компонента отхода производства в пруду накопителе, при которых Сфакт опасного вещества в воздухе над раствором не превышает ПДКi любого типа (рабочей зоны, атмосферного воздуха и т. д. по ОБУВ, ОДУ, ПДКр.з., ПДКс.с. и т. п.). Приведем параметры для расчета давления насыщенного пара ряда широко распространенных экотоксикантов (таблица 16). Таблица 16 Уравнение, интервалы температур и константы, рекомендуемые для расчета давления насыщенного пара ряда органических соединений.
Рассмотрим несколько иной и более строгий метод расчета давления насыщенного пара. С этой целью целесообразно использовать уравнение Клапейрона – Клаузиуса. l = Т где l - молярная теплота фазового перехода, V2 и V1 – молярные объемы газообразной и жидкой фаз. При температурах, далеких от критических, плотность насыщенного пара во много раз меньше плотности жидкости. Тогда l = Т (далее вместо V1 просто V). Если принять насыщенный пар идеальным, что в подавляющем большинстве случаев справедливо в условиях защиты ОПС, то V = RT/P. (17) Подстановка (17) в (16) дает l = RТ2 Разделив переменные и проинтегрировав по температуре в пределах от Т1 до Т2, и по давлению (Р1, Р2), имеем ln Если принять l практически постоянной в заданном температурном интервале, то, зная Р1, можно найти Р2 для заданных температурных условий. В таблице 17 приведены l ряда жидкостей. Таблица 17
Теплоты фазового перехода ряда жидких компонентов отходов при температуре кипения
В таблице 17 указаны li токсичных компонентов отходов при tкип. К сожалению, li существенно зависит от температуры, возрастая с ее снижением. Именно поэтому и рекомендуется использовать формулы вида (12) и (13).

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
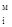 =
=  ,
, = 1,9 × 10-4 и Х
= 1,9 × 10-4 и Х  = 1,9 × 10-3. Столь разбавленные растворы являются практически идеальными и расчет давления насыщенного пара вновь можно проводить по уравнению (9). Его результаты расчета представлены в табли-
= 1,9 × 10-3. Столь разбавленные растворы являются практически идеальными и расчет давления насыщенного пара вновь можно проводить по уравнению (9). Его результаты расчета представлены в табли- (V2 – V1), (15)
(V2 – V1), (15)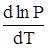 ;
;  .
.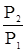 =
=  .
.