|
|
Литий-ионные аккумуляторыРеволюцию в развитии литиевых аккумуляторов произвело использование соединений внедрения лития для изготовления не только положительного, но и отрицательного электродов. Такой аккумулятор был назван литий-ионным аккумулятором (ЛИА, Li-ion battery). Отрицательный электрод. В Li-ионных аккумуляторах отрицательный электрод изготовлен из углерода (графита). Литий-ионные аккумуляторы собирают в разряженном состоянии. Для приведения аккумуляторов в действие их заряжают. При первом заряде происходит формирование отрицательного электрода – ионы лития внедряются (интеркалируют) в графит:
C6 + xLi+ + xе–
При разряде отрицательного электрода ионы лития извлекаются обратно (деинтеркалируют) и снова внедряются (интеркалируют) при заряде:
LiC6
Использование углеродной матрицы сняло проблему катодного восстановления лития в виде дендритов. Однако и в этом случае, как и при использовании сплавов, циклируемость достигается за счет очень существенной потери в удельной емкости и энергии. Для LiC6 теоретическая удельная емкость составляет всего лишь 372 А∙ч/кг (для чистого лития 3860 А∙ч/кг). Предельный состав интеркалята LiC6 определяется кристаллографическими особенностями графита: каждый внедренный атом лития занимает определенное место против центра углеродного кольца в межслойном пространстве кристаллической решетки графита. Различной степени интеркаляции x отвечает несколько соединений: LiC6; LiC12; LiC18 и др. Соединение LiC6 обладает отрицательным электродным потенциалом, который лишь на 0,2 В положительнее потенциала металлического лития в том же электролите. Кроме углеродных материалов в качестве матрицы отрицательного электрода изучаются структуры на основе оксидов олова (SnO, SnO2, SnO2-TiO2(10%) и др. [21]), серебра и его сплавов, фосфориды кобальта, композиты углерода с наночастицами кремния, кремниевые и углеродные нанопровода и нанотрубки. При использовании оксидов олова при первоначальной катодной поляризации электрода литий восстанавливает оксид, а затем внедряется в олово:
SnO2 + 4Li + 4e– → Sn + 2Li2O, (3)
Sn + xLi+ + xe– = LixSn. (4)
Значение х в данном случае может быть довольно большим и достигать значения 4,4, при котором теоретическая удельная емкость электрода составляет 991 мА∙ч/г и 7234 мА∙ч/см3, если считать на массу и объем олова. Электроды на основе SnO2-TiO2(10%) демонстрируют устойчивое циклирование в течение 50–60 циклов при полном разряде с удельной емкостью до 750 мА∙ч/г на первом цикле и постепенным снижением емкости по мере циклирования [21]. Положительный электрод. В качестве материала положительного электрода в ЛИА применяются в основном литированные оксиды переходных металлов, такие как LiCoO2, LiNiO2 и LiMn2O4 с удельной емкостью 120–140 А∙ч/кг. Работа положительного электрода сводится к деинтеркаляции лития из литированных оксидов при заряде аккумулятора и к его интеркаляции в оксид при разряде:
LiCoO2
LiNiO2 = Li+ + e– + NiO2, (6)
LiMn2O4 = Li+ + e– + 2MnO2. (7)
Применение LiCoO2, LiNiO2 и LiMn2O4 обусловлено тем, что они имеют наиболее высокий (среди других литиевых соединений внедрения) положительный потенциал, что обусловливает большее суммарное напряжение аккумулятора. Практический выбор зависит от производителя. Японские фирмы, которые являются основным поставщиком ЛИА на мировой рынок, ориентируются исключительно на кобальтат лития LiCoO2, который имеет лучшие характеристики (наименьшую поляризацию и наибольшую удельную емкость), но токсичен и почти в 10 раз дороже других оксидов. Фирмы в Европе и Америке отдают предпочтение LiNiO2 и LiMn2O4, считая их более перспективными с экономической и экологической точек зрения. Однако стабильность работы LiNiO2 и LiMn2O4 до сих пор остается невысокой. Поэтому постоянно ведется поиск новых катодных материалов для ЛИА, например, предлагаются катоды из различных оксидных наноматериалов. Электролит. Выбор электролита, который во многом определяет стабильность работы литий-ионного аккумулятора, зависит от электродных материалов. Обычно используется смесь органических растворителей, основой которой является этиленкарбонат (ЭК) и диэтилкарбонат (ДЭК). В смесь вводят различные литиевые соли, например LiPF6, тип которых определяет проводимость электролита, состав и морфологию пассивного слоя на положительном и отрицательном электродах. Электролит находится в порах матричного сепаратора из полиолефина. Высокая агрессивность, токсичность и пожароопасность органического электролита в литий-ионных аккумуляторах требует надежной герметизации источника тока. Для исключения термического разгона (1.5, с. 46) используют специальный сепаратор, который при температуре 110°С претерпевает фазовые изменения и закрывает поры, в результате чего значительно увеличивается его внутреннее сопротивление и уменьшается токовая нагрузка. Электрохимическая система ЛИА может быть записана следующим образом:
(–) LiC6 │ LiPF6, ЭК + ДЭК │ LiCoO2 (+).
При разряде и заряде ЛИА на электродах протекают процессы, связанные с неполной интеркаляцией/деинтеркаляцией ионов лития. На положительном электроде:
Li1-xCoO2 + xLi+ + xе–
на отрицательном:
LiC6
Суммарная реакция:
LiC6 + Li1-xCoO2
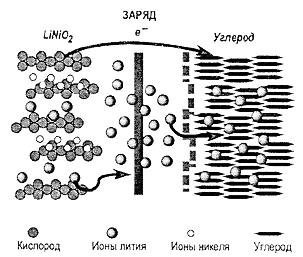
Таким образом, токообразующая реакция сводится к непрерывной перекачке (интекаляции/деинтеркаляции) ионов Li+ через раствор: при заряде из положительного электрода в отрицательный, а при разряде в обратном направлении. Такой тип аккумуляторов часто называют «креслом-качалкой». Схема заряда литий-ионного аккумулятора показана на рис. 1.
Рис. 1. Схема заряда литий-ионного аккумулятора [22].
Нанотехнологии в ЛИА Компания «Toshiba» (Япония) вывела на рынок литий-ионные наноаккумуляторы, получившие название SCiB (Super Charge ion Battery). Отрицательный электрод таких ХИТ изготовлен из нанокристаллов титаната лития и способен поглощать до 80% емкости за минуту. Полная емкость аккумулятора восстанавливается через 2–3 минуты с момента начала зарядки. Опытные образцы обладают высокой удельной емкостью, и при габаритах всего 3,8× 62×35 мм обеспечивают емкость 600 мА·ч. Помимо высокой емкости и быстрого заряда новая батарея имеет увеличенный срок службы: после 1000 циклов заряда/разряда происходит потеря лишь 1% ее емкости, а общий ресурс новых батарей составляет более 5 тысяч циклов. Кроме того, батарея может работать при температурах до –40оC, теряя при этом лишь 20% емкости против 100% у типичных батарей при –25оC. Другая японская компания Matsushita Battery Industrial Co., Ltd. (MBI) разработала цилиндрическую аккумуляторную Li-ion батарею с нанотехнологически обработанным катодом на основе никелевого оксида. Цилиндрическая батарея имеет высокую удельную энергию – до 620 Вт∙ч/л, а непрерывный срок работы может достигать 13 часов. Разработанные в США компанией «Altairnano» литий-ионные аккумуляторы с электродами из наностуктурированных материалов емкостью 35 кВт·ч заряжаются за 10 минут. Дальность пробега автомобиля с такими аккумуляторами на 1 зарядке достигает 200 км. Разрабатываются аккумуляторы емкостью 70 кВт·ч, что позволит увеличить пробег электромобиля до 400 км, сравнимый с бензиновыми машинами и в 3–4 раза превышающий показатель современных электромобилей. В аккумуляторах Altairnano вместо углеродного используется анод из нанокристаллов титаната лития с удельной поверхностью около 100 м2/г. За счет большой площади анода разработчикам удалось значительно увеличить допустимые токи заряда и разряда. К тому же титанат лития меньше подвержен тепловому старению, и новый аккумулятор выдерживает до двадцати тысяч циклов перезарядки. Специалисты Новосибирского института химии твердого тела и механохимии СО РАН разработали новый способ получения катодных материалов для литиевых аккумуляторов на основе различных наночастиц – LiMn2O4, LiV3O8, Li3Fe2(PO4)3, LiMn2O4, LiCoO2 [23]. Новая технология основана на использовании метода механохимической активации. Использование вещества в нанодисперсном состоянии позволяет не только более продуктивно работать с известными катодными материалами, но и создавать совершенно новые химические соединения (LiMeyMn2-yO4, где Me = Co, Cr, Ni, Fe), способные хранить большое количество энергии.
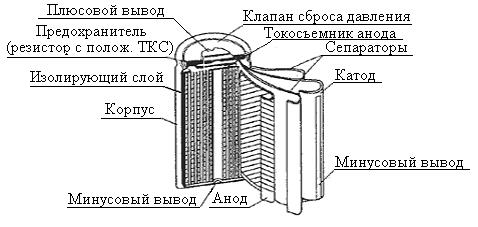
Особенности конструкции Конструктивно большинство Li-ion аккумуляторов, как и щелочных (Ni-Cd, Ni-MH), производятся в цилиндрическом и призматическом вариантах. В цилиндрических аккумуляторах свернутый в виде рулона пакет электродов и сепаратора помещен в стальной или алюминиевый корпус, с которым соединен отрицательный электрод. Положительный полюс аккумулятора выведен через изолятор на крышку (рис. 2). Наиболее распространенный типоразмер корпуса 18650 (18 –диаметр в мм; 650 – длина, мм·0,1). Элементы этого размера имеют емкость от 1800 до 2000 мА·ч. Емкость более крупных типоразмеров 26650 диаметром 26 мм достигает 3200 мА·ч.
Рис.2. Устройство литий-ионного аккумулятора
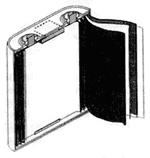
Призматические аккумуляторы производятся складыванием прямоугольных пластин друг на друга. Призматические аккумуляторы обеспечивают более плотную упаковку в батарее, но в них труднее, чем в цилиндрических, поддерживать сжимающие усилия на электроды. В некоторых призматических аккумуляторах применяется рулонная сборка пакета электродов, который скручивается в эллиптическую спираль (рис. 3).
Рис.3. Устройство призматического литий-ионного (Li-ion) аккумулятора с рулонной скруткой электродов
Как правило, конструкции призматических аккумуляторов не унифицированы и большинство производителей сотовых телефонов, ноутбуков и т. д. не допускают применения в своих устройствах аккумуляторов других фирм. Большое распространение получила пакетная конструкция Li-ионных и Li-полимерных аккумуляторов. В связи с отсутствием металлического корпуса пакетные элементы с пластиковой оболочкой имеют малый вес и выпускаются для целевого назначения. В различных видах цифровой аппаратуры используют литий-ионные аккумуляторы таблеточной (дисковой) конструкции, которая рассмотрена в первичных литиевых ХИТ (лаб. раб. № 3, с. 103). Li-ion и другие литиевые аккумуляторы, как и все первичные источники тока с литиевым анодом, отличается абсолютной герметичностью. Требование абсолютной герметичности определяется как недопустимостью вытекания жидкого электролита, отрицательно действующего на аппаратуру, так и недопустимостью попадания в аккумулятор кислорода и паров воды из окружающей среды. Кислород и пары воды реагируют с материалами электродов и электролитом, что не только полностью выводит аккумулятор из строя, но и способствует самовозгоранию и взрыву батареи. Особенности технологии изготовления.Все операции по изготовлению электродов и сборке элементов проводятся в герметичных боксах с атмосферой аргона или смеси аргона с диоксидом углерода.Положительные электроды литиевых и Li-ионных аккумуляторов, а также отрицательные электроды литиевого аккумулятора изготавливают так же, как электроды первичных литиевых элементов. Отрицательные электроды Li-ионных аккумуляторов изготавливают намазкой или напрессовыванием активной массы, состоящей из углеродного материала и связующего, чаще всего поливинилиденфторида, растворенного в N-метилпирролидоне. В некоторых случаях в состав активной массы вводят добавку сажи, которая улучшает пластичные свойства. Разноименные электроды в литиевых и литий-ионных аккумуляторах разделяют сепаратором из пористого полипропилена, в частности из материала Celgard [1]. Аккумуляторы собирают в разряженном состоянии. Для приведения в действие их необходимо зарядить. При первом цикле заряда-разряда литий-ионные аккумуляторы необратимо теряют часть своей емкости, так как в процессе первого заряда, кроме внедрения лития в структуру углеродного материала, происходит разложение электролита с образованием пленки, обладающей ионной проводимостью. Образование пассивной пленки приводит к необратимой потере до 20–30% заложенной емкости. Для снижения этих потерь рекомендуют добавки в электролит, различного рода обработку поверхности углеродного материала, использование токовых коллекторов с активными покрытиями из ацетиленовой сажи [28]. Начиная со второго цикла процесс разряда и заряда литий-ионного аккумулятора сводится к переносу ионов лития от анода к катоду и обратно. Коэффициент использования по току при этом близок к 1.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
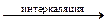 LixC6. (1)
LixC6. (1) Li1-xC6 + xLi+ + xе–. (2)
Li1-xC6 + xLi+ + xе–. (2) Li+ + e– + CoO2, (5)
Li+ + e– + CoO2, (5)