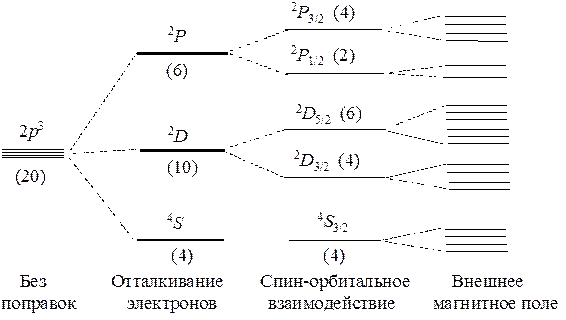|
|
Учет спин-орбитального взаимодействияЕсли учесть спин-орбитальное взаимодействие между векторами L и S, то полная энергия атома будет зависеть от их взаимной ориентации, или от длины вектора полного механического момента, которая описывается значением квантового числа J. Возможные значения этого квантового числа определяются вариантами сложения квантовых чисел L и S: J = L + S, L+ S – 1, ... | L – S |. Для рассмотренного примера с атомом азота получим такие варианты: 1) терм 4S : L = 0 S= 3/2 ; J= 3/2 – 0 = 3/2 2) терм 2P : L = 1 S = 1/2 ; J = 1 + 1/2 = 3/2 и J= 1 – 1/2 = 1/2 3) терм 2D : L = 2 S = 1/2 ; J = 2 + 1/2 = 5/2 и J = 2 – 1/2 = 3/2 В результате внутри термов появляются более мелкие группы состояний — подтермы, внутри которых все состояния характеризуются одинаковой длиной вектора полного механического момента: 1) терм 4S (4 состояния) переходит в подтерм 4S3/2без расщепления, так как в данном случае спин-орбитального взаимодействия нет; 2) терм 2P (6 состояний) расщепляется на два подтерма: 2P3/2 (4 состояния) и 2P1/2 (2 состояния); 3) терм 2D(10 состояний) расщепляется на два подтерма: 2D5/2 (6 состояний) и 2D3/2 (4 состояния). Относительное расположение подтермов на энергетической шкале определяется 3-м правилом Хунда: а) если подоболочка заполнена наполовину и менее (n £ 2l + 1), то минимальная энергия соответствует подтерму с минимальным значением квантового числа J; б) если подоболочка заполнена более чем наполовину (n > 2l + 1), то минимальная энергия соответствует подтерму с максиимальным значением квантового числа J. Для атома азота выполняется первое условие, и, следовательно, энергии подтермов соотносятся следующим образом: 2P3/2 > 2P1/2 и 2D5/2 > 2D3/2 Число состояний в подтерме равно 2J + 1 и определяется числом возможных ориентаций вектора J. В изолированном атоме все состояния подтерма имеют одинаковую энергию. Однако подтерм также можно расщепить, если наложить на атом внешнее магнитное поле. В этом случае энергия будет зависеть от ориентации вектора полного момента относительно внешнего поля. Следовательно, каждый подтерм в магнитном поле расщепится на 2J + 1 подуровень. Суммарная картина расщепления атомных состояний азота по энергии выглядит следующим образом.
Нужно заметить, что подобная картина расщепления характерна только для слабых внешних полей. В этом случае относительные ориентации векторов L и S не изменяются, они остаются жестко связанными друг с другом за счет спин-орбитального взаимодействия. При действии сильных полей спин-орбитальное взаимодействие уже не способно удержать векторы L и S в связанном состоянии. Поэтому оба эти вектора ведут себя независимо. В итоге подтермы в сильных магнитных уже не проявляются, а каждый терм расщепляется на (2L + 1)(2S + 1) энергетических подуровней. Вопросы для самоконтроля 1. В чем различие между задачами описания одноэлектронных и многоэлектронных атомов? Каковы причины введения приближенной "орбитальной модели"? 2. Дайте определение понятия "атомная орбиталь" и "атомная спин-орбиталь". В чем отличие орбиталей от обычных волновых функций? 3. Почему характеристики отдельного электрона в многоэлектронном атоме нельзя рассматривать как обычные механические наблюдаемые? 4. Опишите методику нахождения явного вида АСО методом Хартри-Фока. Каков смысл вариационного принципа? Какова его роль в решении хартри-фоковской задачи? 5. Почему глобальную волновую функцию атома следует строить в виде определителя Слэтера, а не простого произведения АСО? 6. Что такое "эффективный потенциал"? Как этот потенциал влияет на характер движения электронов в многоэлектронном атоме? 7. Почему ХФ-АО выражают в табличной форме? Можно ли от табличной формы перейти к аналитической? 8. В чем смысл "приближения центрального поля"? С какой целью оно используется? 9. В чем различия между хартри-фоковскими и слэтеровскими орбиталями? 10. Каков физический смысл "эффекта экранирования"? 11. Как выражается глобальная энергия многоэлектронного атома? Каков физический смысл остовных, кулоновских и обменных интегралов? 12. Почему полная энергия атома не равна сумме орбитальных энергий отдельных электронов? 13. Каково содержание "оболочечной модели" многоэлектронного атома? По каким критериям электроны объединяются в оболочки (слои) и подоболочки? 14. Что такое "электронная конфигурация" и "электронная формула" атома? Какая из возможных конфигураций называется "основной"? 15. Сформулируйте правила построения основной конфигурации. 16. В чем различие между "ячеечной схемой" и "энергетической диаграммой"? Которую из них следует использовать при построении основной конфигурации атома? 17. В чем различие между заполненными и незаполненными подоболочками? Как сказывается характер подоболочек на физических свойствах атомов? 18. Чем определяется порядок заполнения АО в составе незаполненных подоболочек? Сформулируйте правила Хунда. 19. Дайте определение понятия "атомный терм". Как обозначаются атомные термы? Какую информацию можно извлечь из такого обозначения? 20. В чем причина расщепления атомных термов на подтермы? 21. Как вычисляют полный механический момент атома? Каковы допустимые значения его модуля и проекций? 22. Каков характер расщепления атомных термов в магнитном поле? Чем отличаются случаи слабого и сильного магнитного поля?

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|