
|
|
ХИМИЧЕСКОЕ РАСТВОРЕНИЕ МЕТАЛЛОВ В РАСТВОРАХ СИЛЬНЫХ МИНЕРАЛЬНЫХ КИСЛОТПервоначально В.М.Княжевой при изучении электрохимического поведения хрома, а затем в работах Я.М.Колотыркина и Г.М.Фло-рианович на железе и его сплавах с хромом было показано, что в ряде случаев отсутствует связь скорости ионизации металла с потенциалом. В водных растворах это, как правило, наблюдается в катодной области. Переход к анодной поляризации приводит к возрастанию скорости ионизации в соответствии с экспоненциальной зависимостью (рис. 28, 29). При этом скорость коррозии, полученная экспериментально (iо6щ), много больше рассчитанной посредством экстраполяции поляризационных кривых на потенциал коррозии. Для объяснения полученных данных авторы высказали предположение, что наряду с растворением металлов по электрохимическому механизму возможно и растворение их путем прямого химического взаимодействия атомов металла с окислительными компонентами раствора, сопровождающегося непосредственной передачей электрона от ион-атома металла к частице окислителя.
Рис. 28. Поляризационные кривые (1) и скорость ионизации хрома при различных потенциалах Е и температурах (Т) в 0,1 М сернокислых средах, полученная по данным химического анализа рабочего раствора (2 - 5).
Детально проведенное исследование показало, что зависимости скоростей химического и электрохимического растворения от киcлотности (рН) в водных растворах имеют противоположный характер (рис.30), то есть (dlgiэ/d1gCH+)Сi < 0, а (dlgiх/d1gCH+)Сi > 0.
Рис. 29. Скорость растворения железа в водных растворах HC1 (цифры на кривых - концентрация кислоты, моль/л), по данным химического анализа растворов (а) при 60° С, и связь iо6щ с СH+ при Е = const (б).
Рис. 30. Зависимость скорости химического (1, Е = -0,66 В, t = 900С) и электрохимического (2, Е = -0,35В, t = 200С) растворения железа от величины рН водных сульфатных растворов (Я.М.Колотыркин, Г.М.Флорианович).
Скорость электрохимического растворения увеличивается с ростом концентрации сульфат-ионов. (d1giЭ/dlgC Порядок скорости химического растворения по Н+ для железа составляет 0,33 - 0,5 в интервале рН 0,5 - 4,5 и повышается для стали 1X13 до 1,5. Полученные результаты не позволили авторам сделать заключение о природе частиц, принимающих непосредственное участие в растворении железа и стали по химическому механизму. Частицами-окислителями могут быть ионы водорода в соответствии с уравнением: Ме + nН+¾®Ме"+ + n/2Н2, в частности, для железа Fe + 2H+¾® Fe2+ +Н2. Однако с такой реакцией не согласуются величины (dlgiх/d1gCH+)Сi. Другим объяснением, по мнению авторов, является предположение о стадийном протекании процесса. Причем первая стадия: Ме + Н2О ¾® МеОН + ½Н2 является быстрой, а последующая - лимитирующей: МеОН + Н+ ¾® Ме+ +Н2О с дальнейшим окислением низковалентных частиц в объеме раствора. Исследования по кинетике ионизации железа армко и стали Ст3, проведенные нами в хлористоводородных спиртовых средах, показали, что и в этом случае наблюдается химическое растворение металла (рис. 31). Причем в спиртовых средах iобщ железа армко существенно выше, чем в воде (рис. 31).
Рис. 31. Зависимость скорости растворения железа от потенциала электрода, по данным химического анализа, в 1 М растворе НС1 при 600 С. Растворитель: 1 - Н2О; 2 - С2Н4(ОН)2, 3 - СН3ОН , 4 - С2Н5ОН.
Скорость растворения (iсам), рассчитанная посредством экстраполяции поляризационных кривых до точки пересечения при потенциале коррозии, в 7 - 10 раз ниже полученной из результатов химического анализа коррозионной среды. iсам характеризует эффективность ионизации по электрохимическому механизму (iэ) при условии равенства скоростей анодной и катодной реакции и в результате катодной поляризации может только убывать. Следовательно, при Е < Екор наблюдается iэ < iсам. Разность между iобщ(по анализу среды) и iэ представляет собой скорость коррозии по химическому механизму. Химическое растворение можно определить как процесс ионизации металла, скорость которого не определяется величиной потенциала электрода, а соответствующая реакция на границе раздела металл – жидкая фаза не связана с переносом заряда. В спиртах (d1gix/dlgCC1– )Ci равен нулю. Порядки скорости химического растворения по ионам водорода nH+ = (dlgix/d1gCH+)Ci для различных растворителей показаны в таблице 3. ix - скорость химического растворения. Экспериментальная величина (dlgix/d1gCH+)Ci равная –0,3 (табл. 3), является кажущейся и обусловлена взаимодействием СН3ОН с НС1. Введение добавок воды в спирты снижает ix, увеличивая iЭ. Таблица 3. Влияние природы растворителя на порядок по ионам водорода скорости химического растворения железа армко (комнатная температура) в растворах НС1
При анодной поляризации с ростом разности E–Eкорнаблюдается сближение количества перешедшего в раствор железа, по данным химического анализа коррозионной среды и поляризационных измерений (рис. 32).
Рис. 32. Анодные поляризационные кривые (1) и скорость растворения железа, по данным химического анализа, в 0,1 М этиленгликолевых растворах НС1 при 60°С (2). iЭ и ix - соответственно скорости электрохимическою и химического растворения металла.
Величина ix = io6щ– iЭ, найденная при различных анодных потенциалах, остается постоянной. Соотношение 0 < (dlgix/d1gCH+)Ci < 1, наблюдаемое в водных и этанольных растворах, можно объяснить, допустив два параллельных процесса химического растворения железа, характеризующихся величиной nн+, равной соответственно 0 и 1. Тогда суммарная скорость химического растворения выразится уравнением: ix = k0 + k1CH+, а порядок реакции, в зависимости от соотношения слагаемых, может находиться в пределах 0 < nH+ £ 1. k0 и k1 не зависят от CH+, но, естественно, меняются под влиянием других параметров системы (СH2O, природа спирта, tи др.). Если k0 << k1CH+, то наблюдается первый порядок по ионам водорода, что и реализуется в этиленгликолевых растворах. Кинетические параметры химического растворения, полученные на стали Ст3 нами в спиртовых растворах НС1, практически не отличаются от таковых железа армко. Однако в этом случае в этиленгликолевых средах (dlgix/dlgCH+)Ci равен 1,4. Для марганца Я.М.Колотыркин и Т.Р.Агладзе наблюдали в водных средах порядок скорости химического растворения по ионам водорода, равный 2. По их мнению, процесс складывается из двух последовательных стадий: Мn + Н2О ¾® МnО + Н2; МnО + 2Н+ ¾® Мn2+ +Н2О Мn + 2Н+ ¾® Мn2++Н2 Однако, в целом, величина nH+ для марганца является функцией рН(рис. 33), что невозможно объяснить с позиций предлагаемого авторами механизма без принятия большого количества дополнительных допущений. Для интерпретации соотношения 1 < (dlgix/d1gCH+)Ci £ 2 необходимо допустить параллельное протекание на стали дополнительного процесса сnн+, равным 2. Тогда суммарное уравнение скорости химического растворения принимает вид: ix = k0 + k1CH++ k2C2H+, а nн+, в зависимости от соотношения величин слагаемых, может находиться в пределах 0 < nн+< 2.
Рис. 33. Зависимость скорости химического растворения марганца в водных растворах НС1 от величины рН при комнатной температуре (Я.М.Колотыркин, Т.Р.Агладзе).
В результате электрохимического растворения железа в состав газофазных продуктов может входить только водород. В связи с этим важным является определение количественного состава газообразных продуктов растворения в спиртах, что и было выполнено в лаборатории электрохимии и коррозии Тамбовского государственного педагогического института (1975 – 1985 гг). Для этой цели с помощью специально сконструированной электрохимической ячейки их собирали и подвергали хроматографическому исследованию. Анализ хроматограмм показал, что в состав газа входят пропан, пропилен, н-бутан, и-бутан. Газы выделяются с поверхности электрода как при анодной, так и при катодной поляризации (до 200 мВ от Екор). Их качественный состав не зависит от величины сдвига потенциала, направления внешнего тока или его отсутствия и, следовательно, не связан с электрохимическим окислением или восстановлением растворителя. Замена железа армко на сталь Ст3 приводит к увеличению скорости процесса, но также не изменяет качественного состава газовой смеси. Введение 5 % Н2О в спирт заметно снижает скорость выделения газа. Химическое растворение железа интерпретировано нами с позиций радикального механизма. В метанольных растворах нулевой порядок по ионам водорода соответствует формальной схеме процесса, близкой к следующей: Fe + СН 3ОН ¾®Fe(COH) адс + 3Н* (72) Знак * соответствует занятию частицей одного адсорбционного центра. Образование достаточно стабильных адсорбированных частиц СОН в результате хемосорбции метанола на платине показано *** рядом авторов (А.Н Фрумкин, О.А.Петрий, Б.И.Подловченко, В.Б.Васильев, В.С.Багоцкий, О А.Хазова) и предполагается нами на железе. Этанол и этиленгликоль (Б.Б.Дамаскин, О.А Петрий, В.В.Батраков, Ю.Б.Васильев, В С Багоцкий, О.А. Хазова) при хемосорбции подвергаются деструкции и дегидрированию также с образованием адсорбированных частиц Следовательно, для них первая стадия может иметь сходный вид: Fe + ROН ¾®Fe(COH)адс + где R - углеводородный радикал. В этиленгликоле образуется 2 атома водорода на одну частицу Далее реакции протекают по уравнениям: Fe(COH)адс + H ¾®FeOадс + FeOадс + Н+ ¾®FеOH+; (74) FeOH+ ¾®Fe2+ +OH– (75) При наличии стадии (74) наблюдается первый порядок по ионам водорода, к которому приводит последовательность реакций (72а), (73) и (74). При подобном подходе легко интерпретировать второй порядок по ионам водорода и его последующее снижение с ростом рН. Это имеет место, если стадия (75) протекает по уравнению FеOH+ + Н+ ¾®Fe2+ +H2O (75а) и реализуется последовательность стадий (72а), (73), (74) и (75а). При этом третий член уравнения для iх значительно сильнее зависит от СНС1 и его вклад с ростом рНбыстро снижается. Рассмотрим дальнейшую судьбу радикалов **СН2 и *Н, стабилизированных адсорбцией. Однако прежде отметим, что при хемосорбции этилена на гладкой платине, по результатам А.А Мичри, А.Г Пшеничникова и Р.Х Бурштейн, наблюдается образование частиц с одним (**СН2 и **СН условно С1) и тремя (*СН2 – СН2 – *СН2 условно – С3) углеродными атомами. Последние являются продуктами полимеризации **СН2. Постулируя подобную возможность на железе и образование на его поверхности фрагментов с 4-мя углеродными атомами (*СН2 -СН2 -СН2 - *СН2- условно С4), легко объяснить механизм образования пропана и н-бутана. Адсорбированный на поверхности электрода водород преимущественно взаимодействует с частицами С3 и С4 (помимо процесса 2Н ¾® Н2). Отсутствие рекомбинации атомарного водорода с C1 и С2 фрагментами следует из экспериментальных данных. Это можно объяснить снижением энергии адсорбции С3 и С4 по сравнению с C1 и С2 на одну мономерную группу. Несколько сложнее объяснить образование пропилена и и-бутана Для этого целесообразно привлечь описанный академиком Н.Н.Семеновым эффект изомеризации парафиновых радикалов. В настоящее время этот процесс сравнительно подробно изучен (А.Д.Степухович, В А.Улицкий). Применительно к нашему случаю эти реакции имеют вид: *СН2 - СН2 - *СН2 ¾® СН3 – СН = СН 2 с дальнейшей десорбцией или *СН2 - СН2 - *СН2 ¾® СН3 – *СН – *СН2 Нами постулируется простейшая перегруппировка Зрs - типа, на наличие которой указывают многие авторы. Последующая полимеризация и адсорбция могут быть описаны схемой:
*СН2
*СН2 СН3 десорбцией. Предложенный механизм удовлетворительно объясняет идентичность состава газообразных продуктов ионизации железа по химическому механизму во всех изученных спиртах. Его не трудно распространить и на водные растворы, согласно уравнению: Fe + НОН ¾®FеOадс + 2Н*. Далее процессы практически не отличаются от (73), (74) и (75а). Исходя из предлагаемого механизма, для протекания химического растворения железа необходимо наличие на его поверхности адсорбированных углеводородных радикалов типа ***СОН и *СН2 и атомарного водорода. Появление последнего обусловлено не только деструкцией хемо-сорбированного спирта, но и адсорбцией атомарного водорода, образующегося за счет разряда протонов. Интересно рассмотреть влияние СН+ на ix металла, плохо адсорбирующего водород. Для этого удобно использовать цинк. По нашим данным, в водных растворах НС1 химического растворения цинка практически не наблюдается. Однако в присутствии осадка никеля на цинке последний начинает интенсивно растворяться по химическому механизму. С позиций развиваемых представлений ix » 0 объясняется отсутствием достаточной концентрации Надс на цинке. Наличие покрытия, хорошо адсорбирующего водорода, приводит к появлению химического растворения. Как показали В.И.Вигдорович и Л.Е.Цыганкова, в этанольных и этиленгликолевых растворах HCI цинк растворяется по химическому механизму. Газообразным продуктом растворения является н-пентан. С3Н8, н-С4Н10, С3Н6 и н-С4Н10 обнаружить не удается. Можно полагать, что химическое растворение цинка в спиртовых растворах протекает по сходному с железом механизму. Но снижение СНадс приводит к росту степени полимеризации стабилизированных адсорбцией радикалов **СН2, так как увеличивается время жизни фрагментов (*СН2 )n до их взаимодействия c Надc. Таким образом, уменьшение энергии связи Ме–Н ведет к росту числа **СН2 – групп во фрагменте, что, в частности, наблюдается на нержавеющей стали X18HI0T (5 М растворы НС1 в С2Н5ОН и С2Н4(ОН)2).
КИНЕТИКА РАЗРЯДА ИОНОВ ВОДОРОДА
Электрохимическая реакция разряда сольватированных протонов является в электрохимической кинетике наиболее детально изученным процессом. Фактически на его основе школа А.Н.Фрумкина создала современную теорию кинетики электрохимических процессов. Наиболее подробно разряд протона изучен на ртутном электроде, который позволяет получить чистую и идеально ровную поверхность и на котором практически не протекают побочные реакции разряда-ионизации. В меньшей мере это относится к металлам платиновой группы Несмотря на кажущуюся простоту процесса и значительное число исследований, далеко не все вопросы разряда ионов водорода решены в настоящее время. В частности, пока нет единства мнения на характер замедленной стадии на Pt, значительны трудности в интерпретации механизма на большинстве твердых электродов, не ясно или, по крайней мере, нет единства мнений относительно влияния природы сольватной формы протона на кинетику и механизм разряда. При погружении электрода из платинированной платины в раствор электролита, насыщенный газообразным водородом, на нем устанавливается следующее равновесие. Н2 « 2Н « 2Н+ + 2е, а равновесный потенциал водородного электрода выражается обычным уравнением Нернста: φ = φ0 + φ0 - равновесный стандартный потенциал водородного электрода, принят равным нулю. Катодная поляризация такого электрода приводит к сдвигу равновесия в сторону разряда, анодная - в сторону ионизации водорода. Катодное и анодное перенапряжения процесса: hкат = φравн – φi; hан = φi – φкат, где φi - потенциал при плотности внешнего тока i. Многочисленные экспериментальные данные показывают, что практически на всех исследуемых катодах перенапряжение водорода описывается уравнением Тафеля: hн = a + b lgi, где a и b - константы Тафеля. Величина «b» в подавляющем большинстве случаев описывается выражением b = 2,3 hн = ki На ртути в разбавленных водных растворах сильных минеральных кислот (СH+ –0,1 – 0,001) hн практически не зависит от СH+. Однако в растворах с постоянной ионной силой такая зависимость наблюдается, что будет показано ниже.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|



 )Сi близок к 1, а кинетика химического растворения не зависит от концентрации аниона кислоты и его природы.
)Сi близок к 1, а кинетика химического растворения не зависит от концентрации аниона кислоты и его природы.


 .
. , (72а)
, (72а) СН3 – *СН – *СН2 + *СН2 ¾® СН3–СН–*СН2
СН3 – *СН – *СН2 + *СН2 ¾® СН3–СН–*СН2
 и далее СН3 – CH–CH2 +2H ¾® СН3-СН-СН3 с последующей
и далее СН3 – CH–CH2 +2H ¾® СН3-СН-СН3 с последующей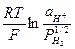
 = 116мВ на единицу логарифма плотности тока при 18оС и лишь при малых hн:
= 116мВ на единицу логарифма плотности тока при 18оС и лишь при малых hн: