|
|
ИЗУЧЕНИЕ СТАТИСТИЧЕСКИХ ЗАКОНОМЕРНОСТЕЙ В ИДЕАЛЬНОМ ГАЗЕ(«Термодинамика и молекулярная физика», «Кинетическая модель идеального газа») ЦЕЛЬ РАБОТЫ:
= Знакомство с компьютерной моделью идеального газа. =Экспериментальное подтверждение основных формул молекулярно-кинетической теории, по которым определяются скорости газовых молекул. =Экспериментальное изучение зависимостей среднего числа столкновений и средней длины свободного пробега молекул от температуры. КРАТКАЯ ТЕОРИЯ: ИДЕАЛЬНЫМ ГАЗОМ называется физическая модель, в которой газ рассматривается как совокупность хаотически движущихся молекул, взаимодействующих между собой лишь при непосредственном ударе, носящем упругий характер. Скорости, характеризующие состояние идеального газа: 1. средняя: 2. .наиболее вероятная: vв = 3. средняя квадратичная: Давление газа - макроскопическое проявление теплового движения и столкновений молекул газа со стенками сосуда. В результате каждого соударения стенке сосуда передаётся определённый импульс. ОСНОВНОЕ УРАВНЕНИЕ молекулярно-кинетической теории для давления: р = ДЛИНА СВОБОДНОГО ПРОБЕГА - расстояние li, которое молекула пролетает от одного столкновения до следующего. СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛЫ:
СРЕДНЕЕ ЧИСЛО СОУДАРЕНИЙ МОЛЕКУЛЫ В ЕДЕНИЦУ ВРЕМЕНИ:
МЕТОДИКА ПРОВЕДЕНИЯ ИЗМЕРЕНИЙ.
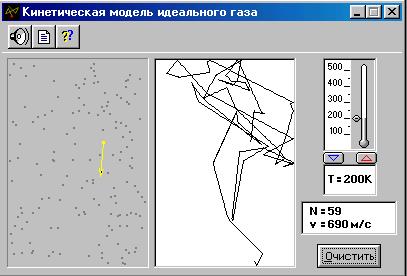
Нажмите кнопку «СТАРТ» во внутреннем окне экрана и проследите за хаотическим движением выделенной молекулы в замкнутом объёме слева во внутреннем окне экрана, вектор скорости которой изменяется при каждом упругом соударении с другими молекулами (их около 100) и со стенками сосуда. Данная молекулярная система является «механической» моделью идеального газа, находящегося при достаточно низком давлении. В правой части внутреннего окна происходит непрерывная регистрация ломаной линии – траектории движения выделенной молекулы - состоящей из отдельных длин свободного пробега молекулы.
ЭКСПЕРИМЕНТ 1. Исследование зависимости скоростей газовых молекул от температуры
ИЗМЕРЕНИЯ И ОБРАБОТКА РЕЗУЛЬТАТОВ ОПЫТА: 1.На мониторе щёлкните мышью кнопку « 2. В нижнем внутреннем окне щёлкните мышью кнопку «ОЧИСТИТЬ» и установите с помощью маркера мыши на термометре температуру 100К. 3. Запишите в табл.1 начальное значение скорости (v1) выделенной молекулы, указанное в нижнем прямоугольнике окна опыта. 4. Отдельными отрывистыми щелчками нажимайте мышью кнопку 5. Запишите в табл.1 второе значение скорости. 6. Продолжите действия по п.4, 5 ещё 18 раз и заполните табл.1. 7. Увеличивая последовательно температуру на 50К, проведите аналогичные измерения скоростей для температур 150К, 200К, 250К, 300К, 350К, 400К, 450К, 500К и заполните табл.2-9. 8. По формулам 9. Постройте графики
10. Определите химическую формулу газа, масса молекулы которого наиболее близка к измеренной массе молекулы. 11. Оцените погрешность проведённых измерений массы молекулы.
ТАБЛИЦЫ 1-9. Результаты измерений скорости молекулы при заданной температуре
Т=100…….500К
ТАБЛИЦА 10. Результаты расчёта скоростей молекул
ЭКСПЕРИМЕНТ 2. Исследование зависимости среднего импульса, передаваемого молекулами при соударении стенкам сосуда, от температуры
ИЗМЕРЕНИЯ И ОБРАБОТКА РЕЗУЛЬТАТОВ ОПЫТА: 1.На мониторе щёлкните мышью кнопку в верхнем ряду кнопок. 2. В нижнем ряду кнопок щёлкните мышью кнопку «ОЧИСТИТЬ» и установите с помощью маркера мыши на термометре температуру 100К. 3. В момент начала отсчёта времени на секундомере щёлкните мышью на мониторе в верхнем ряду кнопку 8 и через 1 мин. остановите движение молекул нажатием кнопки ;. 4. На «моментальной фотографии» траектории движения выделенной частицы подсчитайте N – число ударов этой молекулы о стенки сосуда за одну минуту. Повторите это измерение ещё 2 раза и запишите результаты измерений в табл.11. 5. Увеличивая последовательно температуру на 50К, проведите аналогичные измерения N для температур в интервале 100- 500К и запишите все результаты измерений в табл.11. 6. По формуле 7. Постройте по данным таблицы 11 график
ТАБЛИЦА 11. Результаты измерений числа соударений молекулы о стенки сосуда за 1 мин.
ЭКСПЕРИМЕНТ 3. Исследование зависимости средней частоты взаимных столкновений молекул от температуры ИЗМЕРЕНИЯ И ОБРАБОТКА РЕЗУЛЬТАТОВ ОПЫТА: 1.На мониторе щёлкните мышью кнопку;в верхнем ряду кнопок. 2. В нижнем ряду кнопок щёлкните мышью кнопку «ОЧИСТИТЬ» и установите с помощью маркера мыши на термометре температуру 100К. 3. В момент начала отсчёта времени на секундомере щёлкните мышью на мониторе в верхнем ряду кнопку 8 и через 30с остановите движение молекул нажатием кнопки ;. 4. На «моментальной фотографии» траектории движения выделенной частицы подсчитайте Z – число её взаимных соударений с другими молекулами. Повторите это измерение ещё 2 раза и запишите результаты измерений в табл.12. 5. Увеличивая последовательно температуру на 50К, проведите аналогичные измерения Z для температур в интервале 100- 500К и запишите все результаты измерений в табл.12. 6. По данным таблицы 12 постройте график зависимости
ТАБЛИЦА 12. Результаты измерений числа взаимных столкновений молекул
ЭКСПЕРИМЕНТ4. Исследование зависимости средней длины свободного пробега молекул от температуры ИЗМЕРЕНИЯ И ОБРАБОТКА РЕЗУЛЬТАТОВ ОПЫТА: 1.На мониторе щёлкните мышью кнопку 2. В нижнем ряду кнопок щёлкните мышью кнопку «ОЧИСТИТЬ» и установите с помощью маркера мыши на термометре температуру 100К. 3. В момент начала отсчёта времени на секундомере щёлкните мышью на мониторе в верхнем ряду кнопку 4. С помощью миллиметровой линейки измерьте на экране монитора все отрезки li ломаной линии – траектории движения выделенной молекулы - от одного столкновения до последующего. При этом имейте в виду, что изменения направления движения молекулы при её ударах о стенки сосуда не должны учитываться при измерении длины свободного пробега. 5. Повторите это измерение ещё 2 раза и запишите результаты измерений в табл.13. 5. Увеличивая последовательно температуру на 50К, проведите аналогичные измерения li для температур в интервале 100- 500К и запишите все результаты измерений в табл.13. 6. По данным таблицы 13 постройте график зависимости
Вопросы и задания для самоконтроля
1. Перечислите основные положения молекулярно- кинетической теории идеального газа. 2. Чем обусловлено давление газа с точки зрения молекулярно-кинетической теории? 3. Зависит ли давление газа: а) от плотности газа; б) от температуры; в) от массы молекул? 4. Как изменяются при изотермическом расширении идеального газа: а) средняя кинетическая энергия молекул; б) средняя длина свободного пробега молекул? 5. Как изменяется средняя длина свободного пробега молекул газа: а) при изобарном нагревании; б) при изотермическом увеличении давления? 6. Что называется эффективным диаметром молекулы? 7. Выведите уравнение, связывающее давление идеального газа со средней кинетической энергией его молекул. 8. Сравните изменения числа ударов молекул о стенку сосуда в единицу времени при уменьшении объёма идеального газа в изотермическом и адиабатическом процессах. 9. Как изменяется эффективный диаметр молекулы при увеличении температуры? 10. Как сказывается ограниченное число молекул, участвующих в тепловом движении в компьютерной модели опыта, на его результатах?
ЛИТЕРАТУРА 1. Трофимова Т.И. Курс физики. М.: Высшая школа, 2001, Гл.8, §46-47. 2. Детлаф А.А., Яворский Б.М. Курс физики. М.: Высшая школа, 2000, Гл.10, §10.1, 10.6.
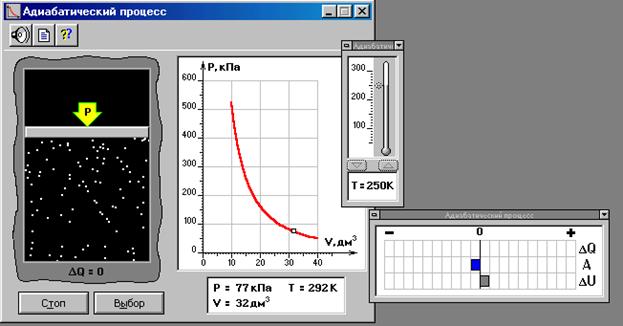
ЛАБОРАТОРНАЯ РАБОТА № 2.2 АДИАБАТИЧЕСКИЙ ПРОЦЕСС («Термодинамика и молекулярная физика», «Адиабатический процесс»)
ЦЕЛЬ РАБОТЫ: * Знакомство с компьютерной моделью, описывающей адиабатический процесс в идеальном газе. * Экспериментальное подтверждение закономерностей адиабатического процесса. * Экспериментальное определение показателя адиабаты, количества степеней свободы и структуры молекул газа в данной модели. КРАТКАЯ ТЕОРИЯ: СОСТОЯНИЕ системы имеет фиксированные значения макроскопических параметров, описывающих систему в целом. Параметры, характеризующие систему в целом, называются ПАРАМЕТРАМИ СОСТОЯНИЯ. Примерами являются температура, давление, объем и т.д. РАВНОВЕСНЫМ называется такое состояние системы, при котором все параметры системы имеют определенные значения, остающееся неизменными сколь угодно долго при неизменных внешних условиях. ОБРАТИМЫМ называется процесс, при реализации которого в обратном направлении система проходит через те же состояния, что и при прямом ходе, но в обратной последовательности. Равновесные процессы всегда обратимы. КРУГОВЫМ процессом (ЦИКЛОМ) называется процесс, при котором система после ряда изменений возвращается в исходное состояние. УРАВНЕНИЕ СОСТОЯНИЯ идеального газа (уравнение Менделеева-Клапейрона) ТЕПЛОЕМКОСТЬ тела численно равна отношению количества тепла d’Q, сообщенного телу, к изменению температуры тела dT, которое при этом произошло: СТЕЛА = УДЕЛЬНОЙ теплоемкостью вещества называется отношение теплоемкости к массе тела. Если тело не меняет свой объем, то оно не совершает работы, поэтому при постоянном объеме тела переданное телу тепло dQ’ идет на изменение его внутренней энергии dU. ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ОБЪЕМЕ СV = ТЕПЛОЕМКОСТЬ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ идеального газа, молекулы которого имеют i степеней свободы CP = ОТНОШЕНИЕ Формула ЧИСЛО (количество) СТЕПЕНЕЙ СВОБОДЫ есть минимальное количество независимых координат, необходимых для однозначного описания положения молекулы в пространстве ИЛИ минимальное количество независимых движений, суперпозиция которых дает любое движение молекулы. ПОСТУПАТЕЛЬНОЕ ДВИЖЕНИЕ всегда дает 3 степени свободы. ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЕ дает 2 степени свободы для линейной молекулы и 3 степени свободы, если атомы в молекуле не расположены на одной линии. КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ дает 2nКОЛ степеней свободы, где nКОЛ – количество независимых колебаний атомов в молекуле (у двухатомной молекулы nКОЛ = 1). АДИАБАТИЧЕСКИМ называется процесс, происходящий без теплообмена с внешней средой (d’Q = 0). Уравнение адиабаты PVg = const (3). С помощью уравнения Менделеева – Клапейрона выражение (3) можно записать в виде связи с другими параметрами состояния газа в адиабатическом процессе:
Работа газа в адиабатическом процессе:
Принято также выделять ИЗОТЕРМИЧЕСКИЙ, ИЗОБАРИЧЕСКИЙ и ИЗОХОРИЧЕСКИЙ процессы.
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ:
ИЗМЕРЕНИЯ: Установите начальное значение объема Vнач = 40 дм3 и начальную температуру Т1 газа, близкую к числам из табл.1. Для этого нажмите кнопку «ВЫБОР», переместите маркер мыши так, чтобы его острие находилось в указанной точке вблизи границы столбика на градуснике, и коротко нажмите и удерживая левую кнопку мыши двигайте столбик. Нажмите мышью кнопку «Старт» на экране и наблюдайте перемещение поршня на левой картинке модели и перемещение точки по красной кривой теоретической адиабаты. Попробуйте останавливать процесс нажатием кнопки «СТОП». Последующий запуск процесса осуществляется нажатием кнопки «Старт». После автоматической остановки процесса запустите его снова, нажав кнопку «Старт», и останавливайте, нажимая кнопку «Стоп», когда крестик на теоретической адиабате (красная кривая) будет находиться вблизи следующих значений объема: 15, 20, 25, 30, 35 и 40 дм3 (6 значений), записывая при остановке значения объема, температуры и давления в таблицу 2. Установите новое значение температуры Т2, взяв его из таблицы 1, задавая Vнач = 40 дм3 и повторите измерения, записывая результаты в таблицу 3.
ТАБЛИЦА 1. Начальные значения температуры) 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

 ;
;  (1)
(1)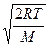 =
= 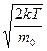 ; (2)
; (2)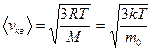 . (3)
. (3)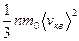 . (4)
. (4)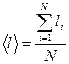 =
= 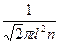 . (5)
. (5)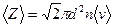 (6)
(6)

 , расположенной в правом верхнем углу внешнего окна опыта, и получить «мгновенную фотографию» всех молекул газа и траектории движения выделенной частицы. Продолжить наблюдение движения молекул в непрерывном режиме можно нажатием кнопки
, расположенной в правом верхнем углу внешнего окна опыта, и получить «мгновенную фотографию» всех молекул газа и траектории движения выделенной частицы. Продолжить наблюдение движения молекул в непрерывном режиме можно нажатием кнопки  или в «пошаговом» режиме последовательными нажатиями кнопки
или в «пошаговом» режиме последовательными нажатиями кнопки  . Обе кнопки расположены рядом.
. Обе кнопки расположены рядом. (7) и
(7) и 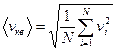 (8) для каждого значения температуры рассчитайте среднюю арифметическую и среднюю квадратичную скорости газовых молекул и запишите эти величины в табл. 10.
(8) для каждого значения температуры рассчитайте среднюю арифметическую и среднюю квадратичную скорости газовых молекул и запишите эти величины в табл. 10. и
и 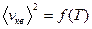 , по ним определите значение массы молекулы m0:
, по ним определите значение массы молекулы m0: (9)
(9) 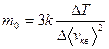 (10)
(10)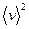

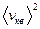
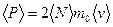 рассчитайте среднее значение импульса, передаваемого молекулами при соударении стенкам сосуда для каждого значения температуры. Значения m0 и
рассчитайте среднее значение импульса, передаваемого молекулами при соударении стенкам сосуда для каждого значения температуры. Значения m0 и 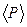 = f(T) и проведите анализ соответствия качественного вида этого графика с выводами молекулярно- кинетической теории и с законами идеального газа.
= f(T) и проведите анализ соответствия качественного вида этого графика с выводами молекулярно- кинетической теории и с законами идеального газа.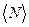
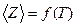 и проведите анализ соответствия качественного вида этого графика с выводами молекулярно- кинетической теории и с законами идеального газа.
и проведите анализ соответствия качественного вида этого графика с выводами молекулярно- кинетической теории и с законами идеального газа.
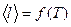 и проведите анализ соответствия качественного вида этого графика с выводами молекулярно- кинетической теории и с законами идеального газа.
и проведите анализ соответствия качественного вида этого графика с выводами молекулярно- кинетической теории и с законами идеального газа.
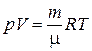 .
.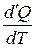 .
. .
. (1).
(1).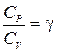 является константой (в определенном диапазоне температур) для данного газа. Эта константа называется показателем адиабаты.
является константой (в определенном диапазоне температур) для данного газа. Эта константа называется показателем адиабаты.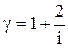 (2) устанавливает связь отношения теплоемкостей g с числом степеней свободы молекулы газа i .
(2) устанавливает связь отношения теплоемкостей g с числом степеней свободы молекулы газа i .
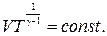
 .
.