|
|
Роль малых ядерных рибонуклеопротеидных частицВ ядрах многоклеточных организмов реакции сплайсинга не происходят самопроизвольно1. На самом деле они катализируются частицами, состоящими из малых ядерных РНК (мяРНК) и белков. Эти малые рибонуклеопротеидные частицы обо-
1 Вызывает удивление, что такой самопроизвольный сплайсинг на самом деле происходит при удалении интронов из транскриптов митохондриальных генов дрожжей и из рибосомной РНК простейшего Tetrahymena (см. Sharp, 1987).
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 192_______________ ГЛАВА 13_____________________________________________________________________________
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК_________________________________ 193
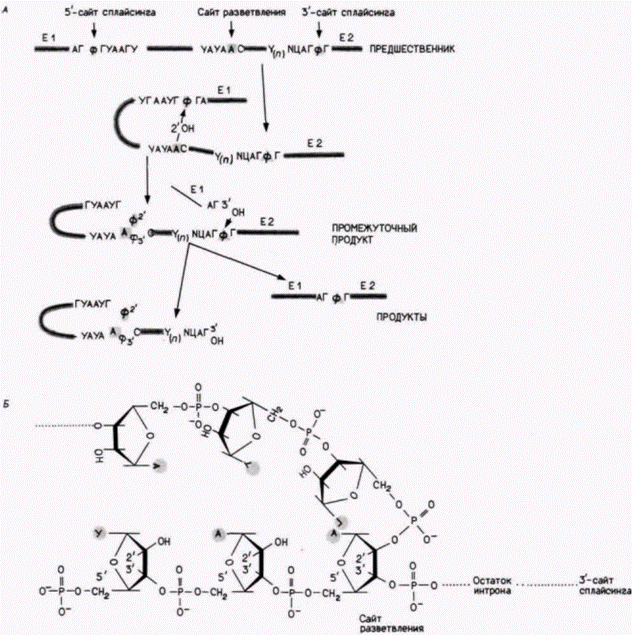
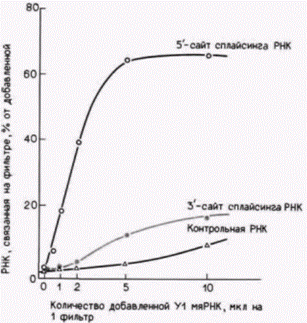
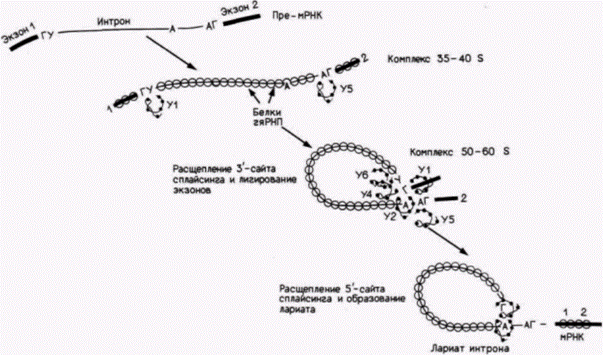
значают как мяРНП. Существует пять основных мяРНК – U1, U2, U4, U5 и U6, – каждая из которых присутствует в количестве от 2·105 до 2·106 копий на ядро и содержит от 56 до 217 нуклеотидов. Помимо этого в меньших количествах содержатся многочисленные другие мяРНК. Каждая мяРНП-частица содержит одну молекулу мяРНК в комплексе приблизительно с десятью белками (Maniatis, Reed, 1987). Первые предположения об участии мяРНП в сплайсинге вытекали из наблюдения, что 5'-концевой участок U1 мяРНК комплементарен 5’-сайту сплайсинга интронов (рис. 13.16; Lerner et al., 1980; Rogers, Wall, 1980). Последующие опыты (Mount et al., 1983; Tatei, 1984) показали, что очищенные U1 мяРНП специфически связываются с последовательностями 5'-сайтов сплайсинга в РНК-предшественниках (рис. 13.17), a U2 мяРНП специфически присоединяются к сайтам разветвления. Если U2 мяРНП смешать с предшественниками мРНК и затем добавить РНКазу, то единственной РНК, защищенной от гидролиза, окажется РНК в сайтах разветвления и в участках, окружающих эти сайты (потому что эти участки закрыты присоединенными U2 мяРНП) (Black et al., 1985). Другие мяРНП, вероятно U5, присоединяются к 3'-сайтам сплайсинга, так как эти мяРНП способны защищать 3'-сайт сплайсинга от расщепления РНКазой (Chabot et al., 1985). Полагают, что взаимодействие опосредовано узнаванием последовательности 3'-сайта белковым, а не рибонуклеиновым компонентом мяРНП (Tazi et al., 1986). Сплайсинг осуществляется только после того, как различные мяРНК войдут в контакт друг с другом и образуют на предшественнике мРНК сплайсосому. Гипотетическая схема сборки сплайсосомы представлена на рисунке 13.16. Когда U1 (и, возможно, U5) мяРНП связываются с предшественником мРНК, они позволяют присоединиться U2. Вероятно, после этого связываются U4, U5 и U6, хотя точный порядок пока не установлен (Grabowski et al., 1985; Black, Sleitz, 1986). Сплайсосома, подобно рибосоме, участвует в сближении различных РНК друг с другом и образует новые ковалентные связи. Конкретные субстраты, промежуточные продукты и катализаторы этих реакций пока неизвестны. Следует помнить также, что сплайсосома не встречается с «голыми» предшественниками мРНК. Сами молекулы пре-мРНК связаны с высококонсервативными основными белками (как показано на рис. 13.18), и эти белки сворачивают РНК в специфические структуры (Skoglund et al., 1983, 1986). Например, комплекс глобиновой яРНК с белком свернут таким образом, что определенные участки предшественника мРНК экспонированы в большей степени, чем другие участки (Patton, Chae, 1985). Поэтому сворачивание РНК этими белками позво-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 194______________ ГЛАВА 13______________________________________________________________________________
ляет с большей эффективностью узнавать определенные сайты сплайсинга, чем другие возможные сайты (свойство, которое становится важным, когда интроны простираются на 10 000 или более нуклеотидов). Некоторые из этих белков, связывающих яРНК, могут быть важны также и для сплайсинга. Группа таких белков (С-белки) обнаружена в сплайсосоме, и антитела против этих белков ингибируют разрезание РНКи образование разветвлений (Choi et al., 1986).
Образование 3’-конца РНК Рибонуклеопротеидные комплексы, как полагают, важны также для определения положения, по которому предшественник мРНК разрезается на 3'-конце и к которому присоединяется полиаденилатный хвост. Первичный РНК-транскрипт содержит 3'-«хвостовую» последовательность, которая простирается далеко за точку, где оканчивается мРНК. Внутри этой области имеется последовательность ААУААА, необходимая для разрезания РНК на расстоянии 10-30 оснований ниже (с 3'-стороны) от этого сайта (Proudfoot, Brownlee, 1976). Мутации в этой последовательности нарушают формирование 3’-конца мРНК (Wickens, Stephenson, 1984; Orkin et al., 1985). Если сайт ААУААА в ß-глобиновой РНК человека изменен на ААЦААА, то 3'-конец новой РНК находится на расстоянии 900 нуклеотидов ниже обычного сайта полиаденилирования в пределах 15 нуклеотидов от следующего сайта ААТААА в 3'-фланкирующей области гена. Отрезание 3'-хвоста и полиаденилирование предшествуют сплайсингу, поэтому реакции сплайсинга проходят на полиаденилированном предшественнике мРНК. Кроме того, как мы видели ранее, в некоторых случаях имеются альтернативные сайты присоединения поли (А) (что наблюдается, например, при синтезе иммуноглобулинов). Что контролирует выбор одного из альтернативных поли(А)-сайтов и как присоединяются поли(А)-хвосты, в настоящее время неизвестно. Возможно, что в узнавании этой последовательности также участвуют мяРНП. Было показано, что антитела к мяРНПосаждают фрагмент РНК, содержащий последовательность ААУААА (Hashimoto, Sleitz,1986), a U7 РНП необходима для разрезания на 3'-хвосте предшественника мРНК гистона Н3 у морского ежа (Strub, Birnstiel, 1987). Механизмы
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК_____________________________ 195 разрезания РНК-предшественников и присоединения поли(А)-хвостов еще предстоит выяснить. Имеется ряд примеров, когда транскрипция прекращается преждевременно и получается транскрипт без поли(А)-хвоста. Его отсутствие приводит к быстрому разрушению укороченной РНК. По-видимому, подобным образом регулируются по крайней мере два белка, контролирующие пролиферацию клеток. В покоящихся клетках инициируется транскрипция этих генов, но образуются неполные транскрипты. И лишь в растущих клетках синтезируются полные РНК (Bentley, Groudine, 1987; Bender et al., 1987). По крайней мере в одном из этих примеров мутации вблизи 3'-конца первого экзона (где может происходить преждевременная терминация) вызывают образование полных транскриптов в клетках, в которых в норме транскрипция оканчивается преждевременно (Gesarman et al., 1987). В этих случаях синтезируется белок, стимулирующий рост клеток, и клетки становятся злокачественными. Транспорт из ядра До сих пор наиболее загадочным в процессинге РНК остается вопрос о том, как он связан с транспортом мРНК из ядра. Полагают, что мРНК выходит из ядра через ядерные поры. Строение такой поры и РНК, проходящая через нее, показаны на рис. 13.19. Если РНК транскрибируется на ядерном матриксе (как предполагалось в гл. 12), то вполне вероятно, что матрикс содержит также мяРНП, необходимые для ее процессинга. На ядерном матриксе были обнаружены предшественники ß-глобиновой мРНК кролика, не прошедшие сплайсинг или прошедшие его частично (Zeitlin et al., 1987), а также прошедшие частично сплайсинг предшественники овальбуминовой мРНК из клеток яйцевода курицы (Ciejek et al.. 1982). Ядерная оболочка со стороны цитоплазмы часто бывает усеяна рибосомами. Не могут ли рибосомы захватывать мРНК, когда она выходит из пор, и вытягивать мРНК из ядер по мере ее трансляции? Мы не можем дать утвердительный ответ на этот вопрос, однако существует по крайней мере один факт, свидетельствующий в пользу такой возможности. При определенной форме ß-талассемии человека мутация локализована в 39-м кодоне, который становится кодоном-терминатором. Естественно поэтому, что мутантный ген не синтезирует ß-глобин. Но этим не объяснить, почему в цитоплазме
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 196____________ ГЛАВА 13___________________________________________________________ наблюдается дефицит ß-глобиновой мРНК. Было обнаружено, что мутантная мРНК (синтезированная на клонированном гене in vitro) не уступает в стабильности ß-глобиновой мРНК дикого типа (Humphries et al., 1984), и было высказано предположение, что для выхода глобиновой мРНК из ядра, возможно, требуется ее трансляция на цитоплазматической стороне ядерной оболочки (Orkin, Kazazian, 1984). Когда эта трансляция прекращается (из-за образования кодона-терминатора), прекращается также транспорт мРНК из ядра. Многое предстоит еще выяснить, прежде чем мы сможем указать этапы, на которых происходит регуляция сплайсинга РНК в развитии. Это могло бы происходить при связывании мяРНП, образовании сплайсосомы, формировании 3’-конца или при транспорте РНК в цитоплазму. Была отмечена гетерогенность U1 класса мяРНП и высказано предположение, что у зародышей Xenopus существует не менее 7 различных типов U1 мяРНК и они характерны для различных периодов развития (Forbes et al., 1984). Авторы этой работы полагают, что различия в последовательностях мяРНК могли бы обусловливать присоединение различных белков, а это в свою очередь позволило бы осуществлять сплайсинг различных предшественников мРНК. Однако в настоящее время мы не можем указать на конкретный внутриядерный механизм селекции определенных специфических РНК-предшественников для процессинга в тканеспецифические цитоплазматические мРНК. Резюме Процессинг РНК должен рассматриваться как основной способ регуляции дифференциальной экспрессии генов. Экспериментальные данные свидетельствуют, что он определяет популяцию специфических для клеток мРНК при развитии морского ежа и, по-видимому, также мыши и крысы. Секвенирование ДНК и РНК показало, что дифференциальный процессинг РНК может приводить к возникновению различных белков в клетках разных типов (кальцитонин или CGRP; IgM или IgD) или в разные периоды в одной клеточной линии (мембрансвязанные и секретируемые IgM; миозины). Полагают также, что регуляция дифференциального процессинга ответственна за детерминацию полового фенотипа дрозофилы. Раскрытие механизма, лежащего в основе дифференциального процессинга РНК, возможно, позволит нам проникнуть в суть клеточной дифференцировки и эмбриональной детерминации. Литература
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ КОНТРОЛЬ РАЗВИТИЯ НА УРОВНЕ ПРОЦЕССИНГА РНК___________________________________ 197
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 198_______________ ГЛАВА 13_____________
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|