|
|
Предотвращение полиспермииСпособность плазматической мембраны яйца к слиянию необходима для его соединения со спермием, однако, как только это слияние произойдет, такая способность становится опасным свойством. У морских ежей, как и у большинства изученных животных, каждый проникающий в яйцо спермий снабжает его гаплоидным ядром и центриолью. При нормальном моноспермном оплодотворении, когда в яйцо проникает только один спермий, гаплоидные ядра спермия и яйца соединяются, образуя диплоидное ядро оплодотворенною яйца (зиготы): при этом восстанавливается присущее данному виду число хромосом. Внесенная спермием центриоль делится и образует два полюса митотического веретена дробления. Проникновение множества спермиев — полиспермия у большинства животных приводит к гибельным последствиям. У морских ежей при оплодотворении двумя спермиями возникает триплоидное ядро, в котором каждая хромосома представлена не двумя, а тремя копиями. Такое оплодотворение приводит к вредным последствиям в особенности потому, что вместо нормального процесса — разделения хромосом с помощью биполярного веретена между двумя дочерними клетками — происходит распределение триплоидного набора между четырьмя клетками. А поскольку не существует механизма, который обеспечил бы получение каждой из четырех дочерних клеток нормального числа и всех необходимых типов хромосом, последние распределяются неравномерно: одни клетки получают лишние копии некоторых хромосом, тогда как у других эти хромосомы отсутствуют (рис. 2.21). Теодор
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 54 ГЛАВА 2 Бовери в 1902 г. показал, что такие клетки либо погибают, либо развиваются атипично. В процессе эволюции животные выработали разные способы, позволяющие избежать объединения более чем двух гаплоидных ядер. Самый обычным способ заключается в том, чтобы предотвратить проникновение в яйцо более чем одного спермия. В яйце морского ежа имеются два механизма зашиты от полиспермии: быстрая реакция, которая осуществляется путем электрических изменений в плазматической мембране, и более медленная реакция, вызванная экзоцитозом кортикальных гранул. БЫСТРЫЙ БЛОК ПОЛИСПЕРМИИ. Для оплодотворения необходимо, чтобы плазматическая мембрана яйца обладала способностью сливаться с мембраной спермия, однако она должна утрачивать эту способность сразу же после того, как первый спермий вступит с ней в контакт (Just. I9I9). Быстрый блок полиспермии достигает этой цели путем изменения электрического потенциала плазматической мембраны яйца. Клеточная мембрана представляет собой своего рода барьер между цитоплазмой яйца и внешней средой, обладающий свойством избирательности, и концентрация ионов по обе стороны плазматической мембраны сильно различается. Это различие особенно значительно для ионов натрия (Na+) и калия (К+). В морской воде концентрация ионов натрия очень велика, тогда как в цитоплазме яйца свободных ионов натрия почти нет. Для ионов калия соотношение обратное. Такое состояние поддерживается плазматической мембраной, которая устойчиво препятствует проникновению натрия в ооцит и утечке ионов калия в окружающую среду. Если один электрод ввести в яйцо, а второй электрод поместить вне его, то можно измерить постоянную разность потенциалов по обе стороны плазматической мембраны. Этот мембранный потенциал покоя, как правило, имеет величину, равную примерно 70 милливольт, что обычно выражают как -70 мВ, поскольку содержимое клетки отрицательно заряжено по отношению к внешней среде. В течение одной десятой секунды после при крепления первого спермия мембрана деполяризуется и мембранный потенциал достигает положительного уровня. Это результат поступления в яйцо небольшою количества ионов натрия, которое доводит разность потенциалов до 0 или даже + 20 мВ (рис. 2.22). Спермии способны сливаться с мембранами, обладающими потенциалом покоя —70 мВ, но неспособны сливаться с мембранами, потенциал которых имеет менее отрицательное значение, чем - 10 мВ. Неизвестно, каким образом прикрепление или проникновение спермия дает сигнал к открыванию натриевых каналов, однако недавно были получены данные (Gould. Stephano. 1987), которые
могут дать ключ к пониманию этого процесса: из спермиев Urechis был выделен акросомный белок, способный открывать натриевые каналы в неоплодотворенном яйце Urechis. Более того, когда яйца подвергали воздействию этого белка, скорость поступления натрия и возникавшее в результате его поступления смешение мембранного потенциала были сходны с аналогичными изменениями, вызываемыми живыми спермиями. Открывание натриевых каналов в яйце индуцируется, по-видимому, прикреплением к нему спермия. При изучении оплодотворения у морского ежа Lytechinus с точной регистрацией времени наступления разных процессов было установлено, что натрий поступает в яйцо до слияния плазматических мембран гамет (Longo et al.. 1986; Hinkley et al., 1986). Джеф (Jaffe, 1976) и ее сотрудники обнаружили, что можно индуцировать полиспермию путем искусственной фиксации потенциала на уровне -70 мВ и можно, наоборот, предотвратить оплодотворение, искусственно поддерживая потенциал на положительном уровне. Быстрый блок полиспермии можно также предотвратить, снижая концентрацию ионов натрия в воде (рис. 2.23). Если содержание ионов натрия недостаточно для того, чтобы вызвать смешение мембранною потенциала до положительных значений, то наблюдается полиспермия (Gould-Somero el al.. 1979; Jaffe, 1980). Электрический блок полиспермии существует также у лягушки (Cross, Elinson. 1980), но его, по-видимому, нет у млекопитающих (Jaffe, Cross. 1983). медленный блок полиспермии. Яйца морских ежей (и многих других животных) обладают еще одним механизмом для обеспечения моноспермности оплодотворения. Быстрый блок полиспермии действует недолго - мембранный потенциал в яйце морского ежа остается положительным только около одной минуты. Это кратковременное смещение потенциала может быть недостаточным для предотвращения полиспермии: было показано (Carroll. Epel. 1975). что если спермии, прикрепившиеся к жел-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. _______________ ОПЛОДОТВОРЕНИЕ: ВОЗНИКНОВЕНИЕ НОВОГО ОРГАНИЗМА 55
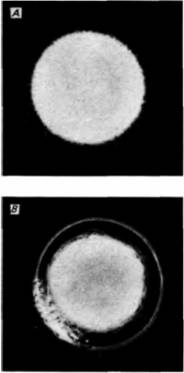
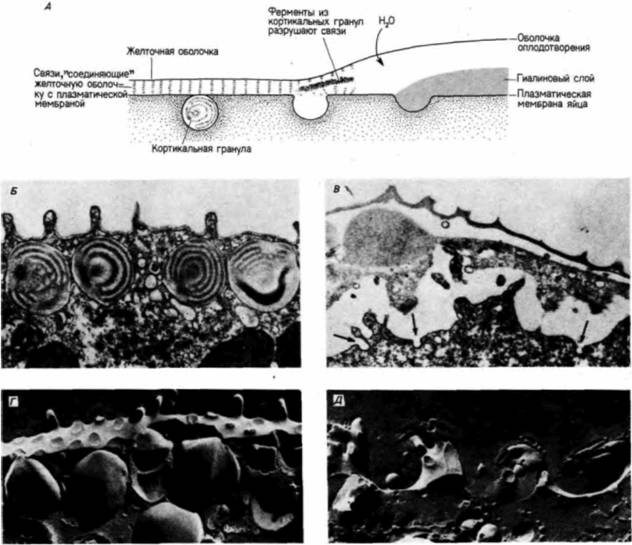
точной оболочке, не будут удалены, то они могут еще проникнуть в цитоплазму. Удаление прикрепившихся сверхчисленных спермиев осуществляется посредством кортикальной реакции, более медленного механического блока полиспермии, который начинает действовать примерно через 1 мин после прикрепления спермия к яйцу. В яйце морского ежа непосредственно под плазматической мембраной располагается 15 000 гранул диаметром около 1 мкм (рис. 2.6,Б). После осуществления контакта спермия с яйцом эти кортикальные гранулы сливаются с плазматической мембраной и выделяют свое содержимое в область между плазматической мембраной и желточной оболочкой. Белки, которые связывали желточную оболочку с поверхностью яйца, растворяются высвободившимися протеолитическими ферментами, а выделенные мукополисахариды создают осмотический градиент, который привлекает воду в пространство между плазматической мембраной и желточной оболочкой. В результате желточная оболочка отделяется от поверхности яйца: с этого момента ее называют оболочкой оплодотворения. Существенно, что в процессе кортикальной реакции желточная оболочка претерпевает важные изменения. Во-первых, воздействие протеаз приводит к изменению свойств биндиновых рецепторов или к их отделению вместе с прикрепленными к ним спермиями (Vacquier et al., 1973; Glabe. Vacquier, 1978). Во-вторых, пероксидаза вызывает затвердевание оболочки путем образования поперечных связей между остатками тирозина соседствующих белков (Foerder. Shapiro. 1977). Как видно из рис. 2.24. образование оболочки оплодотворения начинается в месте проникновения спермия и отсюда распространяется по всей поверхности яйца. По мере формирования этой оболочки спермии отделяются от яйца. Этот процесс начинается спустя примерно 20 с после прикрепления оплодотворяющего спермия и завершается к концу первой минуты после этого. Одновременно происходит выделение гиалина -белка, запасенного в кортикальных гранулах (Hylander, Summers, 1982), который образует сплошной слой вокруг яйца. Плазматическая мембрана слипается с этим белком, и гиалиновый слой поддерживает бластомеры в период дробления. У млекопитающих кортикальная реакция не вызывает образования оболочки оплодотворения, но тем не менее результат ее оказывается таким же, как у морских ежей: выделенные ферменты таκ изменяют рецепторы спермиев прозрачной оболочки, что они больше не удерживают спермии (Bleil. Wassarman, 1980). Этот процесс изменения свойств рецепторов спермиев носит название реакции прозрачной оболочки (реакции zona pollucida или, коротко, реакции зоны - zona reaction). Было высказано предположение (Floiman. Wassarman. 1985), что кортикальные гранулы в яйцах мыши содержат фермент, который отщепляет концевые остатки сахара на ΖΡ3, тем самым отделяя прикрепившиеся к прозрачной оболочке спермии и предотвращая прикрепление к ней новых спермиев. Механизм кортикальной реакции сходен с механизмом акросомной реакции. В результате увеличения в процессе активации концентрации свободных ионов кальция в клетке мембраны кортикальных гранул сливаются с плазматической мембраной яйца, тем самым вызывая экзоцитоз их содержимого (рис. 2.25). Вслед за слиянием кортикальных гранул с мембраной вокруг места проникновения спермия
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 56________________ ГЛАВА 2______________________________________________________________________________
возникает волна экзоцитоза их содержимого, распространяющаяся по кортексу и завершающаяся на противоположной стороне яйца. Нарастание концентрации свободных ионов кальция может быть визуализировано с помощью красителя экворина. Экворин - это белок, который выделяют из люминесцирующих медуз: при соединении со свободными ионами кальция он испускает свет. Этот белок инъецируют в яйца и затем оплодотворяют их. На рис. 2.26 продемонстрирована поразительная картина волны высвобождения кальция, которая распространяется по яйцу. Возникнув в месте проникновения спермия, светящаяся полоса смещается по поверхности и охватывает все яйцо (Gilkey et al.. 1978: Stcinhardt et al.. 1977). Процесс высвобождения и связывания ионов кальция завершается за 1—2 мин; свободные ионы связываются почти сразу же, как только они высвобождаются. В целом ряде экспериментов было показано, что ионы кальция непосредственно отвечают за распространение кортикальной реакции и что они запасаются в самом яйце. Первые данные, свидетельствующие об этом, были получены в 1974 г.. когда неоплодотворенные яйца обработали ионофором А23187. Это соединение переносит ионы кальция через мембраны и позволяет им проникать через барьеры, непреодолимые иным путем. Помещение яиц морского ежа в морскую воду, содержащую A23I87, вызывает кортикальную реакцию и отделение оболочки оплодотворения. Более того, эта реакция может происходить при полном отсутствии ионов кальция в морской воде. Следовательно, A23I87 вызывает высвобождение ионов кальция, уже присутствующих в связанном состоянии в органеллах яйца (Chambers et al., 1974; Steinhardt, Epei, 1974). Данные, полученные позднее (Fulton. Whittingham. 1978; Hollinger, Sdiuirt/. 1976), показали, что ионы кальция, инъецированные в яйца морского ежа, мыши, лягушки, инициируют кортикальную реакцию и что прокаин - анестетик, препятствующий высвобождению связанного кальция, подавляет кортикальную реакцию в яйце морского ежа. Внутриклеточные запасы ионов кальция, вероятно, сосредоточены в эндоплазматическом ретикулуме яйца. В яйцах морских ежей и лягушек, у которых происходит кортикальная реакция, в клетке имеется развитый эндоплазматический ретикулум. окружающий кортикальные гранулы (Gardiner. Grey. 1983; Luttmer, Longo. 1985; рис. 2.27). У двухстворчатого моллюска Spisula, y которого кортикальной реакции не наблюдается (и у которого для активации яйца используется кальций наружной среды), в кортикальном слое яиц эндоплазматический ретикулум развит слабо. При центрифугировании яиц морского ежа были получены результаты, свидетельствующие о том. что источником ионов кальция является область, содержащая элементы эндоплаз-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. ____________ ОПЛОДОТВОРЕНИЕ: ВОЗНИКНОВЕНИЕ НОВОГО ОРГАНИЗМА________________________ 57
матического ретикулума (Eisen, Reynolds. 1985). У Xenopus в период созревания яиц объем эндоплазматического ретикулума в кортикальном слое увеличивается в 10 раз; исчезает он из кортикального слоя за одну минуту после того, как волна экзоцитоза кортикальных гранул пройдет через данную область. Эндоплазматический ретикулум кортекса, накапливающий кальций, сравнивают (Jaffe, 1983) с саркоплазматическим ретикулумом скелетных и сердечной мышц. Возникнув, процесс высвобождения кальция распространяется самопроизвольно. Свободный кальций способен вызвать выход связанного каль-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 58________________ ГЛАВА 2_______________________________________________________________________________
ция из мест, где он аккумулировался, создавая при этом волну высвобождения ионов кальция и экзоцитоз кортикальных гранул. В природе существуют разные варианты стратегии защиты от полиспермии. У млекопитающих частота полиспермии бывает минимальной благодаря малому числу спермиев, достигающих места, где происходит оплодотворение (Brader). Austin. 1954). У хомячка плазматическая мембрана яйца способна сливаться со спермием даже на 4-клеточной стадии (Usui. Yanagimachi. 1976). Блок полиспермии у хомячков и мышей достигается, по-видимому, отделением рецепторов спермиев, находящихся на прозрачной оболочке (Miyazaki. Igusa. 198); Jaffe et al.. 1983). У кроликов же блок полиспермии осуществляется исключительно на уровне плазматической мембраны, и нет сомнений, что этот блок весьма эффективен. Наконец, у некоторых животных имеются механизмы защиты от полиспермии, о которых мы знаем очень мало. Так. в случае богатых желтком яиц некоторых птиц, рептилий и хвостатых ам-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. _______________ ОПЛОДОТВОРЕНИЕ ВОЗНИКНОВЕНИЕ НОВОГО ОРГАНИЗМА_____________________________ 59 фибий в цитоплазму проникает по нескольку спермиев. Все спермии, за исключением одного, разрушаются после того, как женский пронуклеус сольется с одним мужским пронуклеусом (Elinson, 1986); факторы, вызывающие их разрушение, неизвестны. Каков бы ни был механизм элиминации сверхчисленных спермиев у этих животных, благодаря ему только одно гаплоидное сперматическое ядро получает возможность слиться с гаплоидным ядром яйца. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

 •
•