|
|
Соединение гамет у млекопитающихДо сих пор наше обсуждение касалось тех организмов, у которых оплодотворение происходит во внешней среде. У млекопитающих оплодотворение внутреннее и процесс оплодотворения приспособлен к внутренней среде организма. И в самом деле, было обнаружено, что у млекопитающих половые пути самки принимают активное участие в процессе оплодотворения. Спермии млекопитающих сразу после эякуляции не способны к акросомной реакции; для того чтобы эта реакция стала возможной, спермиям необходимо в течение некоторого времени находиться в половых путях самки. Условия, требующиеся для капацитации (приобретения спермиями оплодотворяющей способности), варьируют в зависимости от вида (Gwatkin, 1976); пребывание спермиев в половых путях самки может быть заменено их инкубацией in vitro в жидком содержимом яйцеводов или матки. Одна из гипотез относительно природы процесса капацитации постулирует, что процесс этот заключается в изменениях структуры липидов клеточ-
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с.
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 48 ГЛАВА 2
ной мембраны спермии. Это представление основывается на исследованиях (Davis et al., 1980), которые показывают, что соотношение холестерин : фосфолипиды в мембране спермия по мере капацитации снижается и что молекулы альбумина, имеющиеся в половых путях самки, способны отнимать холестерин у спермия. Продолжительность капацитации различна у разных видов и тесно коррелирует с временем, требующимся для изменения соотношения холестерин:фосфолипиды (Davis. 1981). Полагают, что снижение содержания холестерина дестабилизирует мембрану акросомного пузырька и что без таких изменений липидного состава слияние мембран, наблюдающееся при акросомной реакции, не может осуществиться. Вместе с тем при капацитации с поверхности спермия удаляются особые, связанные с ней вещества ("coating factors"), которые, оставаясь на поверхности, препятствуют оплодотворению (Yanagimachi. 1981). Вопрос о том, как инициируется акросомная реакция у млекопитающих, остается спорным: местонахождение спермиев в момент ее инициации у разных видов может быть различным. Это различие, вероятно, сопряжено с разной способностью спермиев проникать через лучистый венец, окружающий яйцо. У некоторых видов акросомная реакция происходит, по-видимому, в то время, когда спермий находится на некотором расстоянии от яйца. Так, например, по имеющимся данным, у кролика акросомная реакция может быть индуцирована растворимыми веществами, выделяемыми яйцом (Bedford, 1968), тогда как у морской свинки она происходит в определенное время независимо от присутствия яиц (Yanagimachi. Usui, 1974). В этих случаях акросомная реакция приводит к выделению ферментов, лизирующих связи между клетками лучистого венца (Zaneveld, Williams. 1970; Williams. 1972). Выделенные ферменты, называемые лизинами, включают гиалуронидазу, расщепляющую гиалуроновую кислоту, которая составляет большую часть внеклеточного матрикса. и фермент, рассеивающий клетки лучистого венца, специфическим образом разрушая связи между ними. С помощью этих ферментов спермий проходит через лучистый венец и достигает прозрачной оболочки яйца. У наиболее хорошо изученных млекопитающих мыши и хомячка акросомная реакция происходит после прикрепления спермия к прозрачной оболочке (Saling et al., 1979; Florman, Storey. 1982; Cherr et al.. 1986). У этих животных спермии способны, по-видимому, проникать через лучистый венец, не выделяя больших количеств гиалуронидазы (Talbot at al.. 1985). Прозрачная оболочка яиц млекопитающих выполняет такую же роль, как и желточная оболочка у иглокожих. Прикрепление спермия к прозрачной оболочке лишь относительно, а не абсолютно видоспецифично (видовая специфичность при внутреннем оплодотворении — не столь важная проблема). Спермии мыши можно лишить способности прикрепляться к прозрачной оболочке яиц своего вида, если их предварительно инкубировать с гликопротеина-
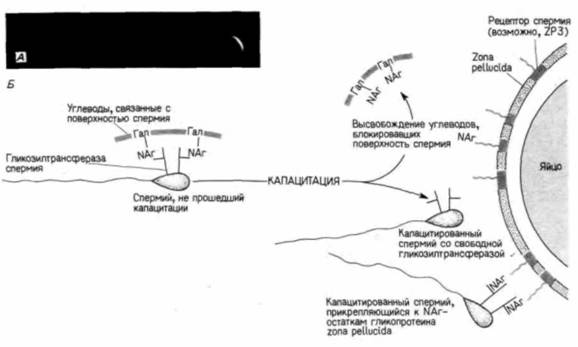
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. _______________ ОПЛОДОТВОРЕНИЕ: ВОЗНИКНОВЕНИЕ НОВОГО ОРГАНИЗМА _____________ 49 ми этой оболочки. В ном опыте активным конкурентом яйца является гликопротеин с молекулярной массой 83000 дальтон (ZP3), выделенный из прозрачной оболочки (Bleil, Wassarman. 1980, 1986; см. рис. 2.17). Таким образом, в прозрачной оболочке содержится особый гликопротеин, к которому прикрепляется спермий. После того как прикрепление произошло, тот же самый белок, как было показано, возбуждает акросомную реакцию. Это позволяет спермию мыши концентрировать свои протеолитические ферменты непосредственно в месте прикрепления к прозрачной оболочке. Спермии всех млекопитающих содержат лизин, разрушающий прозрачную оболочку в месте прикрепления (Stambaugh, Buckley. I960). Этот лизин, называемый акрозином, по аминокислотной последовательности очень сходен с трипсином, и чтобы начать работать, он, подобно трипсину, должен быть активирован. Было установлено (Wincek et al., 1979; Stambaugh, Mastroianni, 1980), что акрозин, находящийся в акросомном пузырьке, неактивен, но под воздействием гликопротеина из половых путей самки происходит его активация. Здесь мы опять убеждаемся в том, что половые пути самки являются не просто каналами для проведения спермы, но и активными участниками процесса оплодотворения. Молекулярный механизм, с помощью которого прозрачная оболочка яйца и спермий млекопитающих узнают друг друга, полностью еще не изучен. Распространенная гипотеза, предложенная для объяснения механизма соединения гамет у млекопитающих, постулирует существование на поверхности спермия белка, способного узнавать видоспецифический углевод гликопротеина прозрачной оболочки (Wassarman, 1987). Показано (Horrnun et al., 1984; Florman. Wassarman, 1985), что у мыши важную роль в узнавании спермия прозрачной оболочкой Играет углеводная группа на гликопротеине ZP3. После удаления этих углеводных групп ZP3 утрачивает способность конкурировать за прикрепление спермия (однако для инициации акросомной реакции, по-видимому, необходима вся молекула гликопротеина). В лаборатории Шура (Shur, Hall, 1982a.b; Lopez et al., 1985) с использованием другого подхода было показано, что рецепторы спермия для прозрачной оболочки представляют собой фермент на поверхности его головки, который узнает сахар N-ацетилглюкозамин (рис. 2.18.4 ). Этот фермент (N-ацетилглюкозамин:галактозилтрансфераза) встроен в плазматическую мембрану спермия непосредственно над акросомой, причем его активный центр обращен наружу. Эта гликозилтрансфераза, вероятно, катализирует присоединение галактозы к углеводной цепи, оканчивающейся N-ацетилглюкозамином. Однако в половых путях самки отсутствуют активированные остатки галактозы. Поэтому, хотя фермент может присоединяться к N-ацетилглюкозаминовым остаткам белков zona pellucida (возможно, к ZP3. что, однако, еще не установлено) точно так же, как любой фермент соединяется с субстратом, он не может катализировать реакцию, поскольку второй ее участник отсутствует. В результате ферменты (на спермии) остаются связанными со своими субстратами (на яйце).
Гилберт С. Биология развития: В 3-х т. Т. I: Пер. с англ. — М.: Мир, 1993. — 228 с. 50________________ ГЛАВА 2______________________________________________________________________________
Если приведенная гипотеза справедлива, то прикрепление спермия можно предотвратить ингибированием фермента или добавлением второго участника реакции – активированной галактозы. Именно такой результат и был получен Шуром с сотрудниками: как при ингибировании гликозилтрансферазы (антителами), так и при завершении реакции (путем добавления УДФ-галактозы) спермий к яйцу не прикреплялся. Эти данные позволили связать обнажение гликозилтрансферазы на поверхности спермия с его капацитацией. Уже около десятка лет известно, что одно из проявлений капацитации — приобретение спермием способности узнавать прозрачную оболочку яйца. На поверхности спермия, не прошедшего капацитации, находятся углеводы ("coating factors"), которые препятствуют его прикреплению к яйцу. При капацитации эти углеводы удаляются, а когда их добавляют к капацитированным спермиям, то спермии утрачивают способность прикрепляться к яйцам. Углеводы, блокирующие прикрепление спермия, представляют собой, по-видимому, полимер из повторяющихся остатков галактозы и N-ацетилтлюкозамина — именно тот тип молекулы, который способен связывать активный центр гликозилтрансферазы в головке спермия. Объединение накопленных данных позволяет создать модель, представленную на рис. 2.18.Б. Прозрачная оболочка выступает как носитель субстрата остатков N-ацетилглюкозамина, а спермий - молекул гликозилтрансферазы, которые к этим остаткам прикрепляются. Капацитация обнажает гликозилтрансферазы на поверхности спермия, и их соединение с N-ацетилглюкозаминовыми остатками прозрачной оболочки по типу ключ-замок прикрепляет спермий к яйцу. Такая же гликозилтрансфераза была обнаружена в спермиях морской свинки и человека, но ее роль в соединении гамет у этих видов предстоит еще выяснить. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|