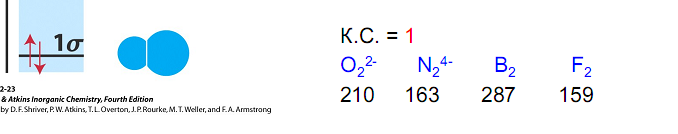|
|
Метод молекулярных орбиталейТеория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул. В этой теории квантовомеханические зависимости для атома распространены на более сложную систему — молекулу. Молекула рассматривается как целое, а не как совокупность сохранивших индивидуальность атомов. В молекуле (как и в атоме) имеются дискретные энергетические состояния отдельных электронов (молекулярные орбитали) с их самосогласованным движением в поле друг друга и всех ядер молекулы. Предполагается, что все электроны данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Состояние электрона в атоме описывается одноэлектронной волновой функцией ψ, являющейся решением уравнения Шрёдингера. Волновая функция ψ, зависящая от четырёх квантовых чисел, имеющая конкретный математический вид и удовлетворяющая условию нормировки и однозначности называется молекулярной орбиталью (МО) (по аналогии с атомной). Каждая орбиталь характеризуется своим набором квантовых чисел, отражающих свойства электронов в данном энергетическом состоянии. В отличие от одноцентровых орбиталей атомов, орбитали молекул многоцентровые, то есть молекулы имеют общие орбитали для двух или более атомных ядер. Каждая молекулярная орбиталь обладает определённой энергией, приближённо характеризующейся соответствующим потенциалом ионизации. По аналогии с атомными s-, p-, d-, f- орбиталями молекулярные орбитали обозначают греческими буквами σ-, π-, δ-, j-. МО образуются при комбинировании атомных орбиталей при достаточном сближении. Совокупность МО молекулы с указанием её типа и количеством электронов на ней даёт электронную конфигурацию молекулы. Существуют 3 типа молекулярных орбиталей: связывающие, разрыхляющие и несвязывающие. Заполнение молекулярных орбиталей происходит так же, как и атомных, с соблюдением принципа Паули, принципа наименьшей энергии и правила Хунда; на каждой МО может находиться не более двух электронов.Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участие в образовании химической связи не принимают. Из исходных атомных орбиталей возникает n МО. Так, при образовании двухатомной молекулы H2 из атомов Н из s-орбиталей двух атомов Н возникают две двухцентровые МО — одна энергетически более выгодная (связывающая σsсв), другая менее выгодная (разрыхляющая σsразр), чем исходные атомные орбитали. На связывающей МО электрон большую часть времени пребывает между ядрами (повышается электронная плотность), способствуя их химическому связыванию. Нa разрыхляющей же МО электрон большую часть времени находится за ядрами, вызывая отталкивание ядер друг от друга. Основные положения метода: 1. Число образующихся МО должно быть равно числу исходных АО. 2. АО, образующие МО, должны иметь близкие или одинаковые значения энергий. 3. Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи в молекуле. 4. АО должны в достаточной степени перекрываться при образовании МО. Поэтому орбитали внутренних слоев атомов практически не участвуют в образовании связи и в методе МО обычно не рассматриваются. В методе МО образование молекулярных орбиталей рассматривается как результат сложения и вычитания комбинируемых АО. Молекулярная орбиталь, возникающая в результате сложения АО, отвечает более низкому значению энергий, чем исходные АО. Такая МО имеет повышенную электронную плотность в пространстве между ядрами и способствует образованию химической связи, она называется связывающей(св.). Молекулярная орбиталь, возникающая в результате вычитания АО, отвечает более высокому значению энергий, чем исходные АО. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее устойчивы, они приводят к ослаблению химической связи и называются разрыхляющими(разр. или *).
Рассмотрим построение такой энергетической диаграммы на примере молекулы водорода Н2 :
НА(1s1) + НВ(1s1) → H2(s1s)2
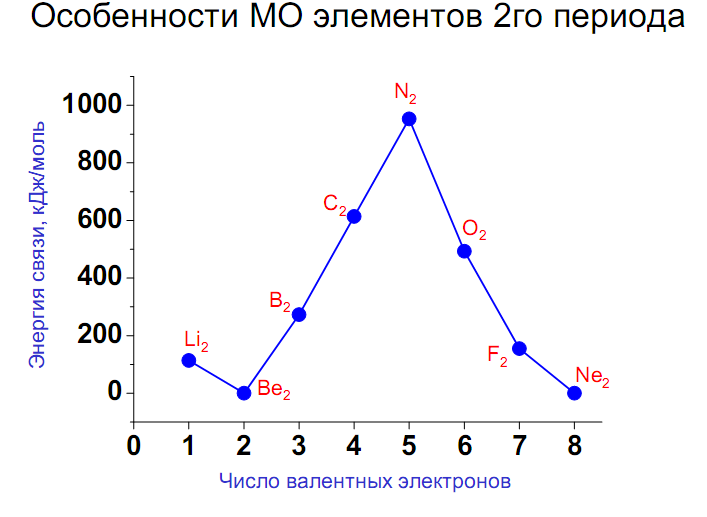
Электроны, занимающие связывающие и разрыхляющие МО, называются соответственно связывающими и разрыхляющими. Устойчивая молекула образуется в случае, если сумма электронов, расположенных на связывающих МО, превышает сумму электронов на разрыхляющих МО. Кратность (порядок) связи равна половине разности числа электронов на связывающих Nсв и разрыхляющих Nразр МО: К. с. = Чем выше кратность связи, тем прочнее молекула.
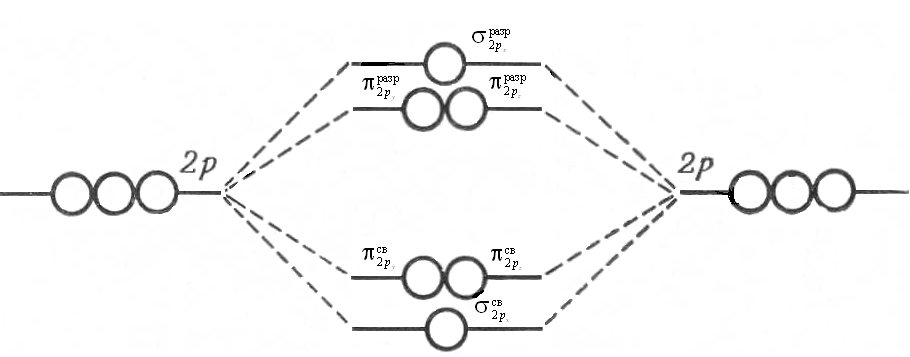
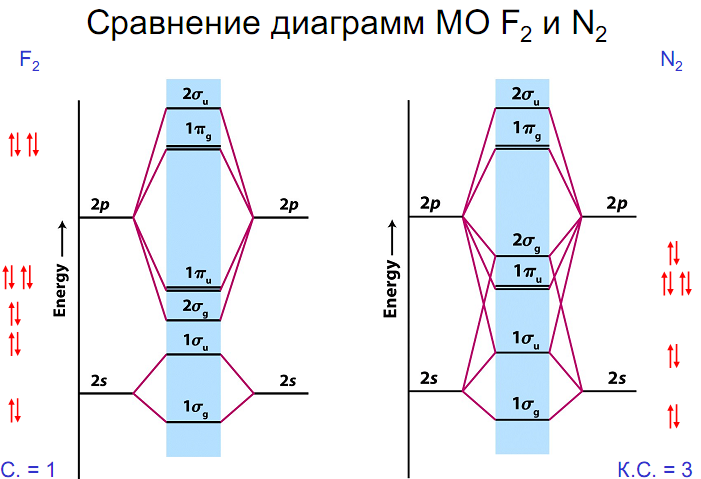
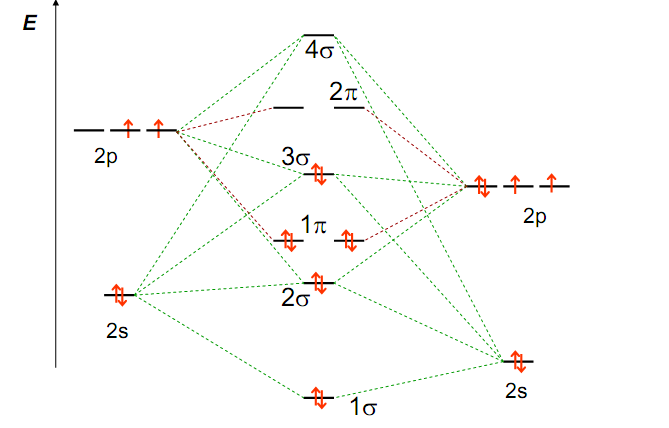
Рассмотрим использование метода МО на примере двухатомных гомоядерных молекул элементов II периода периодической системы. Согласно спектроскопическим данным, молекулярные орбитали двухатомных гомоядерных молекул элементов II периода по энергии располагаются следующим образом: а) для молекул Li2, Be2, B2, C2, N2 этот порядок s АО МО АО

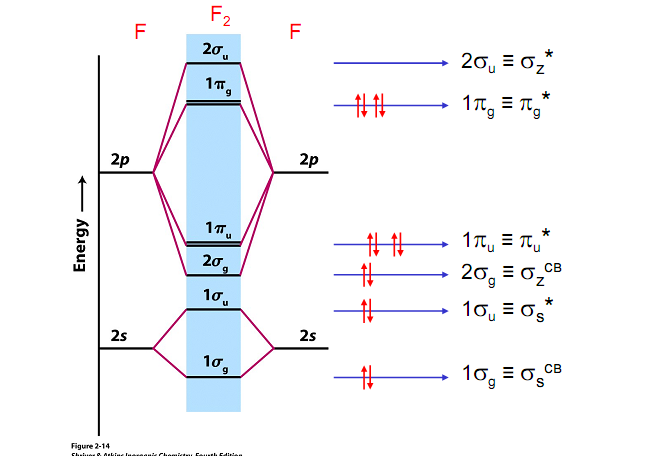
б) для молекул О2, F2, Ne2 этот порядок s
К.
Записав электронную конфигурацию молекулы, можно сделать вывод о прочности и длине связи в молекуле, а также определить ее магнитные свойства.
Метод МО позволяет характеризовать не только молекулы, но и молекулярные ионы. Рассмотрим строение О2 и
МО (О2) КК(s где К – электронная конфигурация К-слоя атомов кислорода, которые практически не участвуют в образовании связи. Порядок связи (О2) = МО Порядок связи Так как порядок связи иона Гетероядерные двухатомные молекулы метод МО описывает так же, как и гомоядерные двухатомные молекулы. В этом случае энергии атомных орбиталей разных атомов различаются. В связывающую орбиталь большой вклад вносит орбиталь более электроотрицательного атома, а в разрыхляющую – орбиталь менее электроотрицательного атома. Энергетические диаграммы молекул типа АВ, где атом В более электроотрицателен, чем атом А, имеют следующий вид :
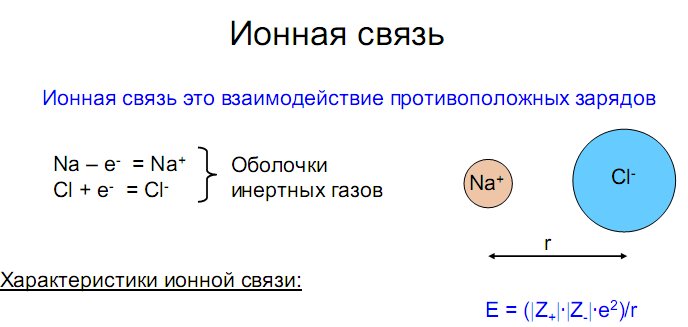
В случае молекул, имеющих три и более атома, энергетические диаграммы все более усложняются. Поэтому описание многоатомных молекул с позиций метода МО становится менее наглядным, а следовательно, и менее удобным. Ионная связь Предельным случаем ковалентной полярной связи является ионная связь. Она образуется атомами, электроотрицательности которых значительно различаются. При образовании ионной связи происходит почти полный переход связующей электронной пары к одному из атомов, и образуются положительный и отрицательный ионы, удерживаемые вблизи друг друга электростатическими силами.
Поскольку электростатическое притяжение к данному иону действует на любые ионы противоположного знака независимо от направления, ионная связь, в отличие от ковалентной, характеризуется ненаправленностью и ненасыщаемостью. Молекулы с наиболее выраженной ионной связью образуются из атомов типичных металлов и типичных неметаллов (NaCl, CsF и т.п.), т.е. когда различие в электроотрицательности атомов велико. Водородная связь Некоторые соединения водорода с сильно электроотрицательными неметаллами имеют аномально высокие температуры кипения:
Температуры кипения воды и фтористого водорода, выпадающие из общей закономерности в приведенных рядах соединений, свидетельствуют о наличии специфического взаимодействия между молекулами. Связи в H2O и HF сильно полярны. Вследствие кулоновского взаимодействия. Кроме кулоновского (электростатического) взаимодействия, при более строгом рассмотрении необходимо учитывать также орбитальное взаимодействие молекул при образовании водородной связи. происходит притяжение противоположно заряженных концов молекул, и возникает межмолекулярная водородная связь:
Энергия такой связи составляет 20–30 кДж/моль, что на порядок меньше энергии ковалентной связи. Тем не менее, водородная связь обусловливает существование в газовой фазе димерных молекул воды и фтористого водорода.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2024 stydopedia.ru Все материалы защищены законодательством РФ.
|

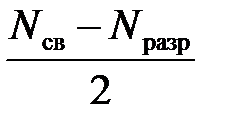 .
.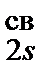 < s
< s  < p
< p 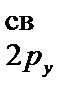 =
= < s
< s 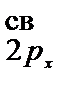 < p
< p  = p
= p 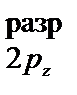 < s
< s  представлен энергетической диаграммой:
представлен энергетической диаграммой:


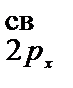 < p
< p  АО МО АО
АО МО АО


 . Изобразимзаполненную электронами энергетическую диаграмму каждой из этих частиц. в соответствии с принципом наименьшей энергии, принципом Паули и правилом Хунда:
. Изобразимзаполненную электронами энергетическую диаграмму каждой из этих частиц. в соответствии с принципом наименьшей энергии, принципом Паули и правилом Хунда:
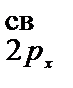 )2 (p
)2 (p 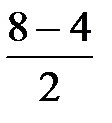 = 2.
= 2.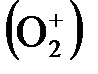 КК(s
КК(s 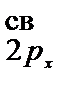 )2 (p
)2 (p  = 2,5.
= 2,5. выше, чем молекулы О2, то ион
выше, чем молекулы О2, то ион 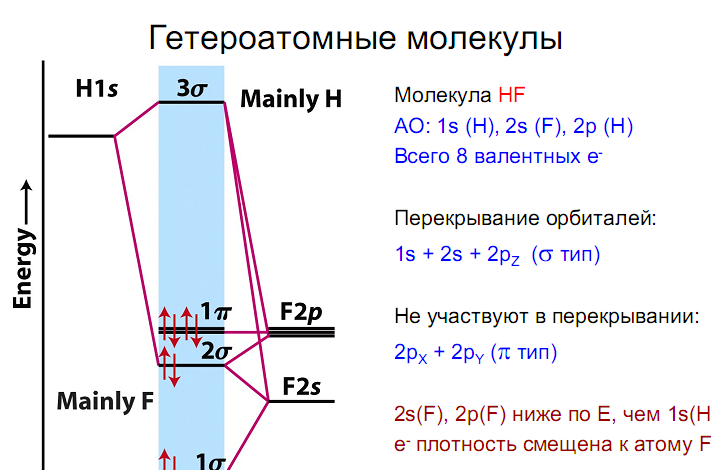

 х
х