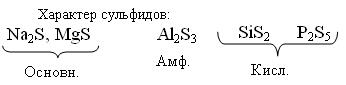|
|
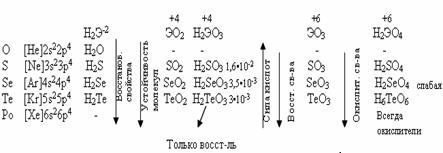
Тема: р - Элементы VI группыОбщая характеристика элементов VI-A группы Элементы VI-A группы - это кислород, сера, селен, теллур и радиоактивный металл полоний. Кислород и сера – неметаллы. Полоний металл серебристо белого цвета, напоминающий по физическим свойствам свинец, селен и теллур, занимающие промежуточное положение, являются полупроводниками. Кислород, сера, селен, теллур – имеют неметаллический характер, называются «халькогены», т.е. образующие руды. На внешнем уровне атомов этих элементов содержится 6 электронов: ns2 np4 . В атомах элементов Se, Te и Po электроны внешнего уровня экранируются от ядра десятью d-электронами предвнешнего уровня, что ослабляет их связь с ядром и способствует проявлению металлических свойств этих элементов. Особенность строения атома кислорода – отсутствие d-подуровня, поэтому валентность кислорода равна 2, но за счёт неподелённых электронных пар кислород может быть донором электронных пар.
8O[He] 2s22p4
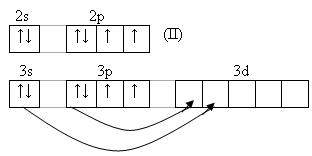
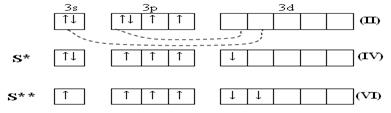
У серы и остальных халькогенов возможен переход p и s-электронов в d–состояние. Поэтому валентность их может быть 2,4,6.
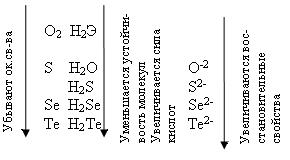
У теллура радиус атома больше, чем у полония за счёт лантаноидного сжатия, т. к. полоний стоит за лантаном. У Po нет радиуса иона, т.к. это радиоактивный элемент. Электроотрицательность элементов группы больше, чем у элементов V-A гр., от кислорода к теллуру закономерно уменьшается. Неметаллические свойства ослабевают с увеличением порядкового номера элементов. Нет монотонного изменения t0C плавления - обусловлено особенностями кристаллической решётки. С увеличением порядкового номера халькогенов понижается окислительная активность нейтральных атомов и растёт восстановительная активность отрицательных ионов.
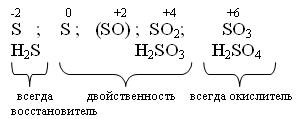
Водородные соединения (гидриды). При обычных условиях Н2О – жидкость, остальных –газы. Все гидриды обладают восстановительными свойствами.
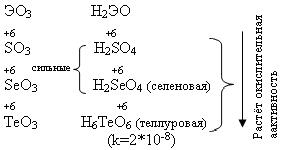
Все оксиды ЭО2 и ЭО3 кислотные, им соответствуют кислоты.
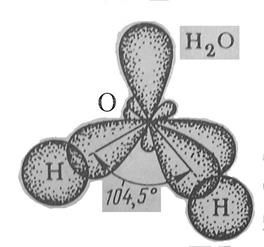
Чем меньше угол, тем меньше полярность, Н2О – самая полярная Химия кислорода
Однако жидкий кислород – обладает парамагнитными свойствами, втягивается в магнитное поле, значит, у него есть неспареные электроны. Учитывая парамагнетизм молекулы О2 можно изобразить строение так:
-длинна связи между неспаренными электронами неодинакова.
Два неспаренных электрона на π - разрыхляющих орбиталях обуславливают парамагнетизм молекулы кислорода.
Для молекулярных ионов: О2+, О20, О2-, О2-2 N (кратность связи) 2,5 2 1,5 1 т.е. положительный молекулярный ион О2+ - самый прочный
При заполнении одной π·2pу орбитали образуются надпероксиды со связью O==O, имеющей кратность 1,5. О2 + ē → О2- Na + O2 → Na+O2- надпероксид. При заполнении обеих π*2p орбиталей происходит образование пероксидов с одинарной слабой связью :О−О: :О≡О: + 2ē → [:O – O :]2- 2Na + O2 → Na2+O2-2 - пероксид После заполнения 2х π*2p и σ*2p орбиталей четырьмя электронами связи молекулы О2 разрываются и образуются оксиды со степенями окисления-2. :О≡О: + 4ē → 2О-2 О2 + 4Na → 2Na2O оксид. Лабораторные способы получения О2 1.Термическое разложение солей 2 KNO3 = 2 KNO2 + O2 2 KСlO3 = 2 KCl + 3 O2 2 KMnO4 = K2 MnO4 + MnO2 + O2 BaO2 = BaO + ½ O2 Промышленные способы получения О2 1. Сжижение воздуха (tкип(O2)= -183oC), tкип(N2)= - 196oC) 2.Электролизом водных растворов щелочей, который сводится к электролизу H2O
Химические свойства О2 1.Плохо растворим в воде 2. Реагирует с большинством металлов и неметаллов 2Са + О2 = 2СаО
4P + O2 = 2P2O5 H2S + O2 = SO2 + H2O 2ZnS + 3O2 = 2ZnO + 2SO2 CH4 + O2 = CO2 + H2O K + O2 = K[O2]- -надпероксид калия
Чем сильнее выражены основные свойства, тем меньше значение энергии Гиббса для реакции с H2O
Na2O + H2O = 2 NaOH ∆G = -147 кДж/моль
MgO + H2O = Mg(OH)2 ∆G = - 17 кДж/моль
Al2O3 + H2O = Al(OH)3 ∆G = - 7 кДж/моль
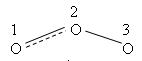
Молекула озона О3. О3 – голубоватый газ с сильным запахом, означает «пахучий»: в сосновых лесах его много, у морского побережья, после грозы. Образуется из О2 под действием УФ излучения и при грозовых разрядах:
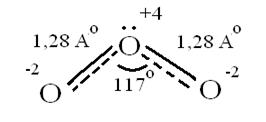
Озон – сильнейший окислитель, окислительная способность обусловлена нестойкостью его молекул, которые при обычной температуре распадаются с образованием атомарного кислорода, который активнее молекулы кислорода О2, на этом и основано окислительное действие его O3 ↔ O2 + O ΔH=-142 кДж/моль Окисляет почти все металлы, действуют на неметаллы, обесцвечивает красители, убивает микробы. При высоких концентрациях – яд. (Один кислород имеет с.о. равную +4).Молекула имеет угловое строение.
Связь трехцентровая ( центральный атом О+4 находится в sp2-гибридизации, связи его с двумя крайними атомами кислорода неравноценны, одна двойная, одна одинарная). Две sp2- гибридные орбитали образуют σ-связи, а 3-я гибридная орбиталь расположена перпендикулярно плоскости молекулы, образуя 3х-центровую 2х-электронную связь с крайними атомами кислорода. Предполагается что центральный aтом кислорода находится в возбужденном состоянии и по донорно-акцепторному механизму пара электронов помещается на пустую орбиталь.
Качественная реакция на озон, крахмальная бумага, смоченная раствором KI синеет в присутствии озона в результате выделения I2 ,озон более сильный окислитель, чем О2 с ним эта реакция не протекает. Земля окружена слоем озона, располагающегося на высоте 25 км от её поверхности. Он образуется за счёт поглощения кислородом ультрафиолетового излучения Солнца. Озоновый слой ограничивает поток ультрафиолетового излучения, падающего на землю. Увеличение интенсивности ультрафиолетового излучения, достигающего Землю, могло бы привести к возрастанию заболеваний раком кожи. Вызывает беспокойство возможное разрушение озонового слоя выхлопными газами реактивных самолётов. Сейчас этот вопрос актуален и широко освещается в печати. Химичесие свойства О3 1. С Металлами Al + O3 → Al2O3 + O2 2. Со сложными веществами PbS + 2O3 → PbSO4 + O2 3. Со щелочами 2 KOH + 7/3 O3 → O2 + 2KO3 + H2O озонид калия Кроме степени окисления +4, кислород может проявлять степень окисления +2 в соединении со фтором O+2F2 и +1 О2+1F2 2 F2 + 2 NaOH → 2NaF + O+2F2 + H2O-2 Окислительно-восстановительная двойственность пероксида водорода Н2О2 Степень окисления кислорода равна -1, т.е. имеет промежуточное значение между степенью окисления кислорода в Н2О (-2) и в молекуле кислорода (0) .
восстановитель двойственность окислитель т.е. Н2О2 проявляет свойства и окислителя и восстановителя. С сильными восстановителями выступает в роли окислителя.
Производные Н2О2 надкислоты и надоснования (пероксосоединения). Обязательно наличие пероксидной цепочки (− О – О−). Надкислоты получаются при замещении водорода в молекуле Н2О2 на кислотные радикалы.
При замене одного атома водорода на металл получаем надоснования К−О−ОН, можно рассматривать как кислые соли пероксида водорода называют гидропероксидами. КО2Н. Важнейшее применение Na2O2 и К2О2 основано на реакции регенерации кислорода. 2Э2О2 + 2СО2 = 2Э2СО3 + О2 Пероксиды используют как источники кислорода для дыхания в автономных системах (подводные лодки, летательные аппараты, батискафы).
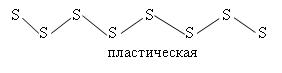
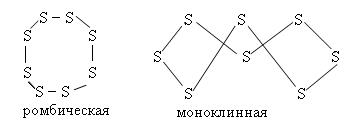
Существует в нескольких аллотропных формах: • жёлтая ромбическая сера (α-сера), при комнатной температуре стабильна. • моноклинная (β-сера), состоит из молекул S8, которая имеет циклическое «зубчатое» строение. • пластическая сера
При плавлении ромбической серы цепочки разбиваются и S8 связывается в S6, S4, S∞ . Если расплавить ромбическую серу при t до 119ºС, то это легко подвижная жидкость. При повышении t до 200ºС вязкость резко повышается и образуется смола. Это связано с разрывом S8 и образованием цепочек пластической серы, которые скручиваются друг с другом. При t>250ºC цепочки пластической серы рвутся и опять образуется легко подвижная жидкость, состоящая из колец S4, S2. Т. о. при нагревании состав молекул меняется. t = 444ºC – закипает. Сера - типичный неметалл. В Н2О не растворима. Взаимодействуют почти со всеми элементами: S + C = CS2 S + F2 = SF6 S + Fe = FeS S + Na = Na2S S + H2 = H2S S + HNO3(конц.) = H2SO4 + NO2 + H2O S + NaOH = Na2S + Na2SO3 + H2O с концентрированными растворами щелочей при t S – диспропорционирует Сероводород H2S – газ, образуется при действии гнилостных бактерий на серусодержащие белки, поэтому его запах ассоциируется с запахом тухлых яиц. Вдыхание чистого сероводорода может привести к мгновенной смерти; даже его 0,01%-ное содержание в воздухе опасно для человека, т. к. он может накапливаться в организме, соединяясь с железом , входящим в состав гемоглобина, образуя сульфид - FeS. Это приводит к тяжелому кислородному голоданию и удушью. Причём окраска крови становится чёрно-зелёной.
Сера менее электроотрицательна, чем кислород, связь слабее поляризована. H2S в лаборатории получают действуя на суфиды кислотой FeS + 2HCl → FeCl2 + H2S↑
Различно реагируют с Н2О Основн. Na2S + H2O → NaHS + NaOH (гидролиз) Амф. Al2S3 + 6H2O → Al(OH)3 + H2S↑ Кисл.SiS2 + 3H2O → H2SiO3↓ + 2H2S↑ Растворимы в Н2О сульфиды щёлочных и щелочноземельных металлов 2NaOH + H2S → Na2S + H2O Нерастворимые сульфиды можно получить взаимодействием соответствующей соли с Н2S
MnSO4 + H2S → MnS↓ + H2SO4 CuS, PbS- чёрные ZnS –белый телесный 1. Есть сульфиды , которые можно перевести в растворимое состояние действием кислот FeS + 2HCl → FeCl2 + H2S 2. Которые нерастворимы в разбавленных кислотах, но реагируют с окислителями CuS + HNO3 → CuSO4 + NO2 + H2O вост. ок. 3. Растворяются в растворах сульфидов щелочных металлов As2S3 + 3Na2S = 2Na3AsS3 H2S и сульфиды - сильные восстановители. 4.Сплавление различных по природе сульфидов Na2S + CS2 → Na2CS3 – тиокарбонат натрия
H2S ↔ H+ + HS- ↔ 2H+ + S-2 слабая кислота. К1=6∙10-8 К2=1∙10-14 Образует средние (сульфиды) и кислые (гидросульфиды) соли. H2S и сульфиды могут окислятся до S, SO2, SO42- H2S + Br2 + H2O → H2SO4 + HBr H2S + H2SO4 → S + H2O H2S + O2 → S + H2O H2S + O2 → SO2 + H2O H2S-2 + I2 → HI- + S0 H2S + HNO3конц → S0↓ + NO2 + H2O 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|







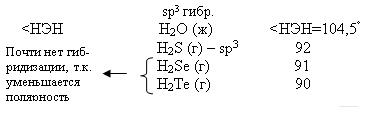
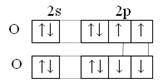 Две аллотропные модификации: молекулярный кислород и озон. Наиболее устойчива молекула О2. Однозначного решения в изображении электронной структуры молекулы О2 еще не найдено. (По методу ВС).
Две аллотропные модификации: молекулярный кислород и озон. Наиболее устойчива молекула О2. Однозначного решения в изображении электронной структуры молекулы О2 еще не найдено. (По методу ВС).
 Более правильно объясняет строение молекулы О2 ММО:
Более правильно объясняет строение молекулы О2 ММО: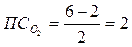

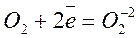
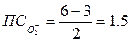


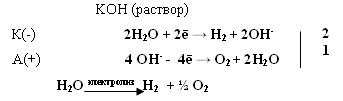
 О2 + N2 эл. разряд 2 NO(t ≈ 3000oC)
О2 + N2 эл. разряд 2 NO(t ≈ 3000oC) 2Na + O2 = Na2O2 - пероксид натрия
2Na + O2 = Na2O2 - пероксид натрия
 3О2 hν 2О3 ∆G = - 323 кДж
3О2 hν 2О3 ∆G = - 323 кДж .
.


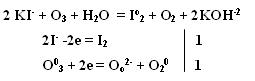
 Н2О-2, Н2О2-1, О2, О+2F2-
Н2О-2, Н2О2-1, О2, О+2F2-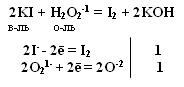

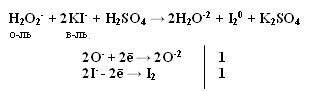
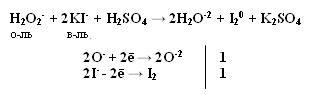
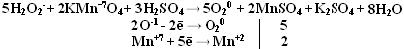

 В H2S угол отталкивания меньше, чем у Н2О
В H2S угол отталкивания меньше, чем у Н2О