
|
|
Тема: s - ЭЛЕМЕНТЫ II ГРУППЫОбщая характеристика элементов II А группы. Физические и химические свойства щелочноземельных металлов Ca, Sr, Ba ), их бинарных соединений, гидроксидов и солей Be, Mg, Ca, Sr, Ba, Ra – элементыII А группы, из них Ca, Sr, Ba, Ra – щелочноземельные металлы, т.к. их гидроксиды обладают щелочными свойствами. Из всех этих элементов только бериллий – является моноизотопным, все остальные полиизотопны. Радий – единственный элемент этой подгруппы, для которого неизвестно ни одного устойчивого изотопа. Все 14 изотопов радиоактивны и среди них наиболее устойчив 226Ra. Атомы элементов на внешнем электронном уровне имеют по 2 электрона с противоположными спинами. В возбужденном состоянии один из двух внешних электронов занимает р-орбиталь 2s 2p

Радиусы атомов их меньше, чем у атомов щелочных металлов, поэтому потенциал ионизации больше. От Be(Mg) к Ra увеличивается радиус атома и иона, в соответствии с этим усиливаются металлические свойства. Причем они менее выражены, чем у щелочных металлов. У щелочноземельных металлов – тип металлических структур:Be, Mg – ГПУ (гексагональная плотная упаковка) Ca, Sr – ГКУ (гранецентрированная кубическая упаковка) Ba – ОЦКУ (объемно-центрированная кубическая упаковка)
ГПУ ГКУ ОЦКУ
Температура плавления и кипения бериллия, а также твердость значительно превосходит остальные элементы подгруппы, это связано с тем, что бериллий образует наиболее прочную кристаллическую решетку. Стандартный электродный потенциал уменьшается сверху вниз, соответственно. Восстановительная активность увеличивается от Ве к Ra, но они менее активные восстановители, чем щелочные металлы. Незакономерное изменение физических свойств: плотности, температуры плавления, температуры кипения обусловлены существенными различиями в строении пространственных кристаллических решеток. В свободном состоянии это легкие металлы, тверже щелочных, самый мягкий барий, имеют серебристо-белый цвет. Для элементов II-A группы характерна степень окисления +2, соединения со степенью окисления +1 – неустойчивы. Все окисляются на воздухе и бериллий, и магний покрываются плотной пленкой оксидов, защищающей их от воздействий. Но остальные металлы взаимодействуют с кислородом воздуха более энергично, поэтому хранят также как и щелочные. При нагревании все металлы сгорают на воздухе с образованием оксидов.
При высоких температурах взаимодействуют с азотом, образуя нитриды.
Взаимодействуют с водой, вытесняя водород, все кроме бериллия, магний реагирует медленно и только при высоких температурах, а остальные бурно, т.к. в ряду стандартных электродных потенциалов находятся левее водорода.
Магний сначала образует оксид, а затем гидроксид.
Магний покрыт оксидной плёнкой MgO, который растворяется в H2O при нагревании.
Гидролиз бинарных соединений (при нагревании)
СаS + 2H2O → Ca(OH)2 + H2S↑ Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3↑ CaC2 + 2H2O → Ca(OH)2 + C2H2↑ CaH2 + 2H2O → Ca(OH)2 + 2H2↑ Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3↑ Mg2Si + 4H2O → 2Mg(OH)2 + SiH4↑ Ca, Sr, Ba легко взаимодействуют с водородом, а Be, Mg – не взаимодействуют. Наряду с обычными оксидами в отличие от Be и Mg образуют пероксиды
Гидроксиды щелочноземельных металлов – сильные основания (щелочи). Be(OH)2 - aмфолит. Mg(OH)2 – как основание средней силы хорошо растворяется в кислотах и в растворах солей аммония
С ростом ионных радиусов Э2+ в ряду Be-Ba растет растворимость гидроксидов и усиливаются основные свойства в ряду Са(ОН)2 – Sr(OH)2 –Ba(OH)2. Об этом можно судить по значениям
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
Малорастворимые гидроксиды бериллия и магния получают с помощью реакций обмена между солями этих металлов и щелочами. MgCl2 + 2KOH → Mg(OH)2↓ + 2KCl
Гидроксиды рассматриваемых элементов разлагаются при нагревании.
Из разбавленых кислот (кроме HNO3) эти металлы вытесняют водород
разбавленную HNO3 восстанавливают до иона аммония, концентрированную как активные металлы до N2О
Способы получения Получение бериллия. 1. Из оксидов, фторидов пирометаллургическим методом, т.е. при высокой температуре (восстановители – CO, C, Mg).
2. Электролиз расплавов солей.
Получение магнияиз оксидов восстановлением C и Si
Mg + H2≠ Ca - электролизом расплавов солей, Sr и Ba- алюмотермией 3
Растворимость солей: Хорошо растворимы: хлориды, бромиды, иодиды и нитраты. Плохо растворимы сульфаты (кроме MgSO4), карбонаты, фосфаты, силикаты. Сульфиты – малорастворимы в воде и сильно гидролизуются. Все соли бария токсичны, применяются в сельском хозяйстве как инсектициды – яды для борьбы с вредными насекомыми (BaCl2, BaCO3).
Особенности бериллия
Также как литий отличается от элементов I-A группы, Be – отличается от элементов II-А группы. Атом Ве имеет на предвнешнем электронном уровне только два электрона, в отличие от остальных элементов II-A группы, у которых их по 8. У него наименьший радиус. Поэтому Ве проявляет диагональное сходство с Al. Ве и его аналоги при нагревании с галогенами образуют галогениды ЭГ2. Их получают также действуя НГ на металл или на Э(ОН)2. Be + Cl2 → BeCl2 ЭГ2 – кристаллические вещества. В молекуле BeCl2 в наружном слое 4 электрона. Ве – может быть акцептором электронных пар и образовывает две связи по донорно-акцепторному механизму. Cl – донор электронной пары.
В итоге при конденсации BeCl2 образуются линейные полимерные цепи. Бериллий образует бинарные соединения: Be + O2 = 2BeO Be + S
и разлагаются водой
В обычных условиях бериллий не образует простых ионов, как и для алюминия, для него характерны катионные и анионные комплексы, где координационное число Be равно 4 (Кч.Be = 4); в водных растворах не существует иона Be2+ так как он гидратирован. Также как и алюминий бериллий обладает амфотерными свойствами, растворяется и в кислотах и в щелочах
Be + 2H+ + 4H2O = [Be(H2O)4]2+ + H2↑
Be + 2OH- + 2H2O = [Be(OH)4]2- + H2↑ Be пассивируется концентрированной азотной и серной кислотами, но при нагревании реагируют с этими кислотами:
Амфотерный оксид Ве взаимодействует при сплавлении как с кислотными так и с основными оксидами.
Как и оксид, амфотерны сульфиды и галогениды бериллия. BeS + Na2S → Na2BeS2 Кис. осн. BeS + SiS2 → Be2[SiS4] Осн. кис. BeF2 + NaF → Na2[BeF4] Кис. осн. BeF2 + SiF4 → Be[SiF6] Осн. кис. Амфотерен и гидроксид бериллия
Соль бериллия, образованную слабой кислотой, можно получить только непосредственно соединением элементов, но нельзя получить смешиванием водных растворов, так как идет совместный гидролиз солей. Все соединения Ве токсичны. С учетом особенностей его свойств, применяется в атомной технике, электронике.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ), за счет чего атомы могут быть двухвалентными.
), за счет чего атомы могут быть двухвалентными.






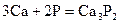


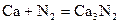
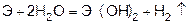







 .
. образования ЭСО3 в реакции:
образования ЭСО3 в реакции:
 ,кДж/моль 25,1 -38,1 -74,9 -110,0 -128,0
,кДж/моль 25,1 -38,1 -74,9 -110,0 -128,0

 ;
;

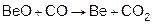





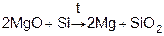



 BeS
BeS





 (бериллат натрия)
(бериллат натрия) (ортосиликат бериллия).
(ортосиликат бериллия).
