
|
|
Общая характеристика элементов III -A группы.Известно 30 р - элементов в периодической системе, это элементы, расположенные в III-A - VIII-A группах. У р - элементов заполняется электронами р- подуровень внешнего электронного уровня. III-A группа – B, Al, Ga, In, Tl – характеризуются наличием 3-х электронов в наружном электронном слое атома, причем у бора на предвнешнем слое атома – 2 электрона, у алюминия – 8 электронов, Ga, In, Tl – 18 электронов. III группа самая элементоемкая – содержит 37 элементов, включая лантаноиды и актиноиды. Все элементы металлы, за исключением бора. При переходе от Al к Ga радиус атома уменьшается. Это связано с тем, что у Ga заполнение р - подуровня начинается после того, как заполняется 3d10 электронная оболочка. Под действием 3d10 - электронов электронная оболочка всего атома сжимается и размер атома уменьшается (эффект d - сжатия). Монотонного (последовательного) изменения металлических свойств не наблюдается. Металлические свойства резко усиливаются при переходе от бора к алюминию, несколько ослабевают у галлия, и вновь постепенно растут при переходе к таллию. Обусловлено это тем, что атома Ga происходит сжатие электронной оболочки за счет d –электронов (эффект d – сжатия) , In, Tl (в отличие от B и Al) содержат по 18 электронов на предпоследнем слое. Поэтому нарушается линейное изменение свойств (rат, Тпл и т.п.) от Al к Ga. Температура кипения закономерно уменьшается от B к Tl. Температура плавления незакономерно из-за особенностей строения кристаллической решетки. Самый легкоплавкий металл – Ga (Тпл = 29,8˚С). В невозбужденном состоянии конфигурация внешнего уровня ns2np1, в возбужденном состоянии - ns1np2. В невозбужденном состоянии имеется 1 неспаренный электрон, однако соединения большинства этих элементов, в которых их степень окисления +1, очень неустойчивы и наиболее характерна для них степень окисления +3 в возбужденном состоянии, т.к. на перевод электрона из s-состояния в р - надо немного энергии.
B – неметал, Al – еще не типичный металл, Ga, In, Tl –типичные металлы. Соединения: ЭН3, Э2О3, Э(ОН)3.
Ga [Ar]4s24p1 (GaH3)n In [Kr]5s25p1 (InH3)n Tl [Xe]6s26p1 TlH3 Э2О3 B2O3 кислотный оксид Al2O3 амфотерный оксид Ga2O3 амфотерный оксид (с преобладанием основных свойств) In2O3 амфотерный оксид (с преобладанием основных свойств) Tl2O ( Tl2O3 ) основной оксид Э(ОН)3
  H3BO3 ортоборная кислота H3BO3 ортоборная кислота
Al(OH)3 амфотерный гидроксид Ga(OH)3 амфотерный гидроксид In(OH)3 амфотерный гидроксид TlOHосновной гидроксид
Образуют соединения с галогенами ЭГ3, серой Э2S3, азотом ЭN. Много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов и гидроксидов, способность образовывать многочисленные полимерные структуры, стеклообразование оксидов. Бор. Получение. Химические свойства Бор по своим свойствам наиболее схож с элементом IV-A группы кремнием («диагональное сходство»). Бор – кристаллическое вещество, черного цвета, тугоплавкое при t = 2300 С. Наиболее распространены две модификации бора: аморфный и кристаллический. Аморфная модификация наиболее реакционноспособна. Получение бора 1. Термическое разложение гидридов бора: B2H6 2. Магнийтермией из оксида бора: B2O3 + 3Mg B2O3 + Zn 3. Из хлорида бора: 2BCl3 + 3Zn Непосредственно активно бор реагирует только со фтором, однако при нагревании протекает взаимодействие с кислородом, азотом, углеродом. B + 2F2 → BF4 4B + 3O2 2B + N2 4B + 3C Бор реагирует с горячими концентрированными кислотами H2SО4 и HNO3 B + H2SO4конц. → H3BO3 + SO2↑ + H2O B + HNO3конц. → H3BO3 + NO2↑ + H2O Со щелочами реагирует только в присутствии сильных окислителей: B + NaOH + H2O2 → NaBO2 + H2O Однако аморфный бор может реагировать со щелочами при кипячении: Bаморфн. + NaOH SiO2 + B → Si + B2O3 Галогениды бора BF3 BCl3 BBr3 BI3 газ газ жидкость твердый Ecвязи кДж 644 443 376 284
ВСl3 образуется посредством взаимодействия трех электронов атома бора в возбужденном состоянии. Образуется три связи по спин - валентному (обменному) механизму.

Так как в галогениде BГal3 имеется свободная орбиталь за счет атома бора, то в этом случае молекула BГal3 может быть акцептором электронной пары и участвовать в образовании связи по донорно-акцепторному механизму.
 
Ион имеет тетраэдрическую структуру

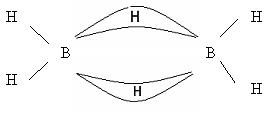
Галогениды бора имеют кислотный характер и гидролизуются: BCl3 + H2O → H3BO3 + HCl BF4 + HF → H[BF4] (сильная кислота) Кислотные галогениды реагируют с основными галогенидами: ВF3 + NaF = Na[BF4] С водородом бор непосредственно не реагирует. Гидриды бора получают не прямым взаимодействием с водородом, а косвенным путем. Например, действием соляной кислоты на борид магния. Мg3В2 + 6HCl ® В2Н6 +3МgCl2 Получается смесь бороводородов (боранов). Бораны известны газообразные, жидкие и твердые. В2Н6 – диборан – газ В4Н10 – тетраборан – жидкость В10Н14– твердый боран. Они имеют неприятный запах и очень ядовиты. Большинство из них самовоспламеняются и разлагаются водой. 2В4Н10 + 11 О2 = 4В2О3 + 10 Н2О В2Н6 + 6 Н2О = 2Н3ВО3 + 6Н2 В молекулах бороводородов атомы бора связаны водородными «мостиками».
Бораны – особый вид соединений, в них образуется электроннодефицитная связь. В их молекулах электронов меньше, чем необходимо для образования двухэлектронных связей. Это так называемая «банановая связь», образуется в результате перекрывания двух sp3-гибридных орбиталей атомов бора и одной s-орбитали атома водорода. Каждый мостиковый атом водорода образует с двумя атомами бора общую двухэлектронную трехцентровую связь В – Н – В. Соединения с дефицитом электронов являются акцепторами электронов.
при температуре 4НВО2 = Н2В4О7 + Н2О Н2В4О7 = 2В2О3 + Н2О H2B4O7 ↔ 2H+ + B4O72- (кислых солей не образует) В отличие от обычных кислот ортоборная кислота не отщепляет Н+, а вызывает смещение равновесия диссоциации воды, присоединяя за счет донорно-акцепторного взаимодействия OH-, выступает в роли одноосновной. B(OH)3 + H2O → B(OH)4- + H+ Кд = 5,8 ·10-10 Координационное число бора по кислороду равно 3, поэтому кислородные соединения бора образуют полимерные соединения (полибораты). Все кислоты превращаются в ортоборную: HBO2 + H2O → H3BO3 H2B4O7 + 5H2O → 4H3BO3 Если ортоборная наиболее устойчивая кислота, то соли ее не существуют в обычных условиях по сравнению с солями мета- и тетраборной кислот. Так при действии на раствор борной кислоты гидроксидом натрия получается не ортоборат, а тетраборат натрия (при недостатке NaOH) или метаборат (в избытке NaOH): 2NaOHнед + 4H3BO3 = Na2B4O7 + 7 H2O NaOHизб + H3BO3 = NaBO2 + 2H2O При избытке щелочи образующийся тетраборат натрия превращается в метаборат натрия: Na2B4O7 + 2NaOHизб = 4NaBO2 + H2O Кислотный гидролиз тетрабората натрия приводит к образованию ортоборной кислоты: Na2B4O7 + 2HCl + 5 H2O = 2NaCl + 4 H3BO3 Алюминий По содержанию в земной коре занимает первое место среди металлов и третье среди всех элементов, после кислорода и кремния. Металлические свойства его выражены сильнее, чем у бора. Химические связи алюминия с другими металлами в основном ковалентного характера. Тип кристаллической структуры - ГПУ. В отличие от бора атом алюминия имеет свободные d-подуровни на внешнем уровне. У Al3+ небольшой радиус и довольно высокий заряд, за счет чего он является комплексообразователем с координационным числом 4 или 6. Соединения Al более устойчивы, чем бора.
Получение алюминия В промышленности Al получают электролизом расплава Al2O3 в криолите (Na3AlF6)
Al2O3 → Al+3 + AlO3-3 K (-) Al+3 + 3e = Al0 A (+) 2AlO3-3 – 6e = Al2O3 + Ga, In, Tl – рассеянные элементы, встречаются в оксидных и сульфидных рудах. В этом случае соответствующие соединения концентрируют и действуют восстановителями. Э2O3 + 3H2 → 2Э + 3H2O Э2O3 + CO → 2Э + CO2 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
 B [He] 2s22p1 В2Н6
B [He] 2s22p1 В2Н6 2B + 3H2
2B + 3H2 устойчивость падает
устойчивость падает


 O2
O2