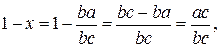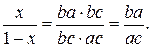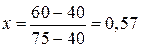|
|
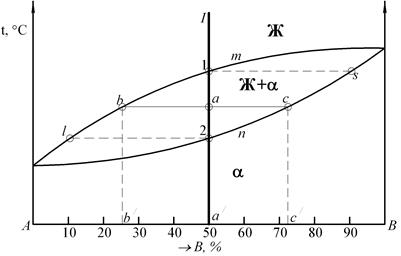
Точки диаграммы состояния свинец-сурьма
Рис. 9. Часть диаграммы состояния свинец-сурьма и кривые охлаждения
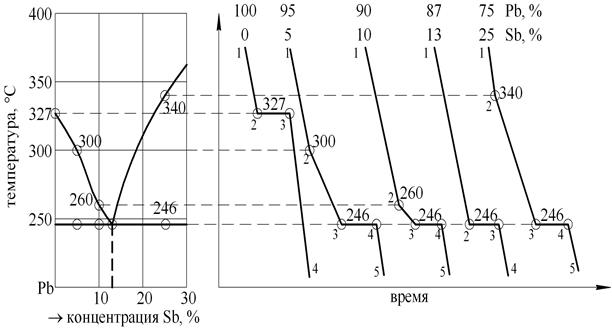
Воспользовавшись правилом фаз, найдем число степеней свободы на каждом участке полученных кривых. Кривая охлаждения чистого Pb: На участке 1-2, С=1–1+1=1 (компонент – Pb, фаза – жидкость). Можно изменять температуру, не изменяя агрегатное состояние. На участке 2-3, С=1–2+1=0. В равновесии находится максимальное число фаз и нельзя изменять ни одну степень свободы без изменения фазового состава. На участке 3-4, С=1–1+1=1, можно изменять температуру, не изменяя агрегатного состояния.
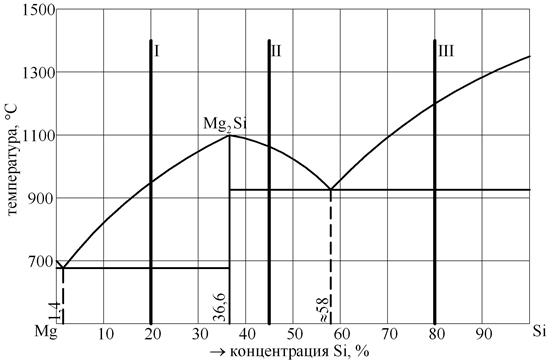
Кривая охлаждения сплава 95 % Pb 5 % Sb: На участке 1-2, С=2–1+1=2 (компоненты – Pb и Sb, фаза – жидкая). Можно изменять температуру и концентрацию без изменения агрегатного состояния. На участке 2-3, С=2–2+1=1 (фазы – жидкость, кристаллы Pb). На участке 3-4, С=2–3+1=0 (фазы – жидкость, кристаллы Pb, кристаллы Sb). Одновременная кристаллизация Pb и Sb должна протекать при одной температуре - Т = 246 °С. На участке 4-5, С=2–1+1=2. Можно изменять температуру и концентрацию без изменения агрегатного состояния. ЗАДАЧА № 5 Найдите число степеней свободы на каждом участке кривых охлаждения сплавов олово-цинк (рис. 7). Покажите на кривых охлаждения фазовые переходы. ЗАДАЧА № 6 Дана диаграмма состояния магний-кремний (рис. 10). Постройте кривые охлаждения для сплавов, содержащих 1,4 % Si 98,6 % Mg, 20 % Si 80 % Mg, 40 % Si 60 % Mg, 80 % Si 20 % Mg.
Рис. 10. Диаграмма состояния Mg-Si
ПрактическОЕ занятие № 3 Правило отрезков
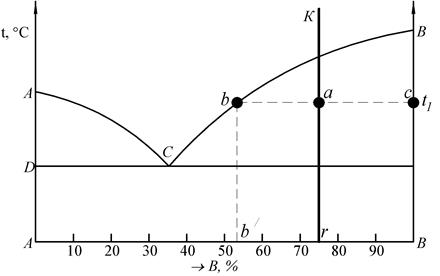
В процессе кристаллизации изменяются и концентрация фаз и количество каждой фазы (при кристаллизации количество твердой фазы увеличивается, а жидкой уменьшается). В любой точке диаграммы, когда в сплаве одновременно существует две фазы можно определить количество обеих фаз и их концентрацию. Для этого служит так называемое правило рычага или правило отрезков. 1 Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область, проекции точек пересечения на ось концентраций показывают составы фаз. Следовательно, для сплава К при температуре t1 составы обеих фаз определяются проекциями точек b и с, так как эти точки находятся на пересечении горизонтальной линии, проходящей через точку а, с линиями диаграммы.
Рис. 11. Диаграмма состояния (к применению на ней правила отрезков)
2 Для определения количества каждой фазы предположим, что сплав К находится при температуре t1. Сплав К содержит r % В и (100 – r) % А. Следовательно, если отрезок на оси абсцисс АВ определяет все количество сплава, то отрезок rА – количество В в сплаве, а отрезок rВ – количество компонента А в сплаве. В точке а сплав состоит из кристаллов В и жидкости, концентрации b. жидкость содержит b/ % В или в жидкости количество компонента В определяется отрезком Аb/. При общем весе сплава, равном единице, искомое количество выделившихся кристаллов равно x, а количество жидкости 1 – x. В этом случае количество компонента А, который находится только в жидкости, равно b/B (1 - x) = b/B – x b/B = rB, x b/B = b/B – rB, Так как b/B – rB = b/r = ba, b/B = bc, то т.е. если масса сплава равна единице и изображается отрезком bc, то масса кристаллов в точке а у сплава К равна отношению ba/bc. Количество жидкости
т.е. количество жидкости определяется отношением aс/bc. Отношение количества твердой и жидкой фаз определяется отношением
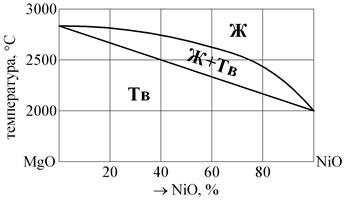
Если точка а определяет состояние сплава, точка b – состав жидкой фазы, точка с – состав твердой фазы, то отрезок bс – определяет все количество сплава, отрезок ас – количество жидкости и отрезок bа – количество кристаллов. Для того, чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками определяющими составы фаз, обратно пропорциональны количествам этих фаз. Правило отрезков в двойных диаграммах состояния можно применять только в двухфазных областях. В однофазной области имеется лишь одна фаза; любая точка внутри области характеризует ее концентрацию. При наличии одновременно трех фаз в двойной системе количество фаз нельзя определить, так как в процессе кристаллизации их количество непрерывно меняется. ЗАДАЧА № 7 Постройте график зависимости весовой доли жидкой фазы при 2500 °С от содержания NiO в сплаве MgO-NiO. РЕШЕНИЕ При температуре 2500 °С твердая фаза может содержать до 40 % NiO, а жидкая – до 25 % MgO. Поэтому при 2500 °С область составов от 0 до 40 % NiO соответствует только твердой фазе, а в области составов от 75 до 100 % NiO твердая фаза вообще отсутствует.
Рис. 12. Диаграмма состояния системы MgO-NiO Обозначим жидкую фазу через x и определим ее весовую долю для состава 60 % NiO и 40 % MgO:
Рис. 13. Зависимость весовой доли жидкой фазы от сплава при 2500 °С
ЗАДАЧА № 8 Каков состав и количество фаз сплава I в точке а, каков состав a-кристаллов сплава I после равновесной кристаллизации, в чем различия кристаллизации компонента А и сплава состава точки а/ (рис. 14)? ЗАДАЧА № 9 Определите концентрацию компонентов в фазах и количественное соотношение фаз для сплавов II, III при Т = 1000 °С, сплава I при Т = 800 °С (рис. 10 практического занятия № 2).
Рис. 14. Диаграмма состояния сплава А-В
Практическое занятие № 4 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

 ,
,